Окислительно-восстановительный потенциал
Многие элементы в земной коре имеют способность находиться в различных состояниях окисления. Так, например, для железа известны три состояния — Fe°, Fe2+ и Fe3+, для марганца три —Мn2+, Мn3+, Мn4+, для урана два — U4+ и U6+ и т. д. Переход из одной степени окисления в другую сопровождается изменением растворимости, изоморфных свойств, что может привести к разделению близких до этого элементов, выпадению одного из них в осадок и т. д.
Окислительно-восстановительный потенциал рассматривается по отношению к потенциалу нормального водородного электрода, условно принятому за нуль:
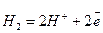
Соответственно иные окислительно-восстановительные реакции располагаются выше (при положительных значениях потенциала) либо ниже (при отрицательных значениях потенциала) потенциала нормального водородного электрода.
Существует два типа окислительно-восстановительных реакций, ограничивающих поле, в котором происходит большинство реакций, протекающих на поверхности земной коры, — разложение воды с выделением свободного кислорода:
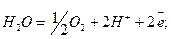
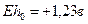
и восстановление водорода:
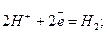
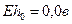
Поскольку в этих реакциях участвует ион водорода Н+, то на них будет весьма сильно сказываться величина рН. Значения Eh, приведенные в табл. 8.3, даны для. рН = 0. С увеличением значения рН на 1 Eh будет также изменяться на -0,06 в. Так, например, при рН = 7 Eh для обеих приведенных выше реакций будут соответственно равны 0,81 и -0,41 в. Точно так же большинство окислительно-восстановительных реакций будет заметно снижать свой потенциал при возрастании рН в окружающей их среде. Существует общее правило, говорящее о том, что окисление происходит тем успешнее, чем выше рН раствора (рис. 8.3).
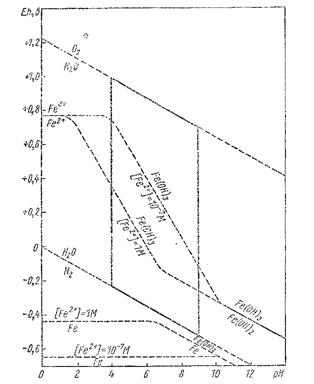
Рис. 8.3. Область окислительно-восстановительных реакций, протекающих в земной коре.
Окислительно-восстановительные реакции приведены в табл. 8.3 в последовательности убывания величины потенциала. Очевидно, что каждая реакция этого ряда будет восстановительной для расположенной ниже и, наоборот, будет окислительной для расположенных выше. Иначе говоря, следуя этому правилу, мы сможем сказать, что до тех пор, пока не будет окислена вся масса меди, не начнется окисление V3+ в V4+, лишь после окисления ванадия начнется превращение U4+ в U6+, и уже после этого сможет произойти окисление Fe2+ в Fe8+.
На одном урановом месторождении нами наблюдался минеральный парагенезис урановой смолки и магнетита. В дальнейшем месторождение подверглось воздействию углекислых вод, вызвавших интенсивную мартитизацию руд. Под влиянием этого процесса сложились следующие соотношения минералов: вначале шло замещение магнетита мартитом; мелкие кубики уранинита, запечатанные
Таблица 8.3
Окислительно-восстановительные потенциалы некоторых реакций
| Реакция | Eh, в | Реакция | Eh, в |
| Co2+=Co3++e | +1,85 | U4+=U6++2e | +0,41 |
| Ni2++2H2O=NiO2+4H++2e | +1,75 | V3+=V4++e | +0,4 |
| Pb2++H2O=Pb2O+4H++2e | +1,5 | 2Cu=CuO2+2e | +0,345 |
| 2H2O=O2+4H+4e | +1,23 | H2=2H++2e | 0,0 |
| V4+=V5++e | +1,00 | Fe0=Fe2++2e | -0,45 |
| Fe2++Fe3++e | +0,77 |
дила до них, начиналась коррозия кубиков уранинита в результате окисления U4+ в U6+, сопровождающегося растворением урана и его выносом. Заканчивался процесс образованием сплошного поля мартита с гематитом, замещавшим кубики уранинита.
Для более точных расчетов следует иметь в виду, что окисли-
тельно-восстановительный потенциал зависит от отношения концен-
траций (активностей) веществ, участвующих в реакции:
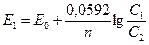
где п — число электронов, С1 и С2 — активности веществ, отвечающие потенциалу Е1 и нормальные концентрации, отвечающие стандартному потенциалу.
С этим, в частности, связан потенциал, несколько сдвинутый в область высоких концентраций водородных ионов реакции Fe2+→ Fe(OH)3 при концентрации иона Fe1+ 1М по сравнению с более низкими его концентрациями.
На рис. 8.6 очерчен параллелограмм ABCD, представляющий собой область, лежащую между значениями рН 4 и 9 и Eh-0 и 1, 2 в и охватывающую все наиболее частые окислительно-восстановительные реакции, протекающие на земной поверхности.
Дата добавления: 2015-08-14; просмотров: 1255;
