Ионный потенциал
Ионным потенциалом[14] называется отношение валентности иона к его радиусу ω/R. Эта величина является весьма показательной для иона, так как определяет многие его свойства. Чем выше ионный потенциал элемента, тем больше склонен он быть активным поляризатором других ионов, и, наоборот, при уменьшении ионного потенциала он начинает приобретать свойства пассивной поляризации.
Гидратация иона также прямо пропорциональна его ионному потенциалу.
Размеры ионных потенциалов даны в табл. 8.1.
Таблица 8.1.
Ионные потенциалы
| Ион | Ионный потенциал | Ион | Ионный потенциал |
| Cs+ | 0,60 | Th4+ | 3,9 |
| Rb+ | 0,68 | Ce4+ | 4,3 |
| К+ | 0,75 | Fe3+ | 4,7 |
| Na+ | 1,0 | Zr4+ | 5,1 |
| Li+ | 1,5 | Be2+ | 5,7 |
| Ва2+ | 1,5 | А13+ | 5,9 |
| Sr2+ | 1,8 | Тi4+ | 5,9 |
| Са2+ | 2,0 | Mn4+ | 6,7 |
| Mn2+ | 2,5 | Nb6+ | 7,5 |
| La3+ | 2,6 | Si4+ | 9,5 |
| Fe2+ | 2,7 | Mo6+ | 9,7 |
| Со2+ | 2,8 | Вз+ | 13,0 |
| Mg2+ | 3,0 | Р5+ | 14,0 |
| Y3+ | 3,3 | S6+ | 20,0 |
| Lu3+ | 3,5 | C4+ | 25,0 |
| Sc3+ | 3,7 | N5+ | 38,0 |
Из приведенных величин становятся понятными причины близкого соосаждения гидратированных ионов Ве2+, А13+ и Ti4+.
На рис. 8.2 показаны диаграммы геохимического разделения элементов в зависимости от их ионного потенциала. На диаграмме изображены три поля: растворимых катионов со сравнительно малы ми значениями
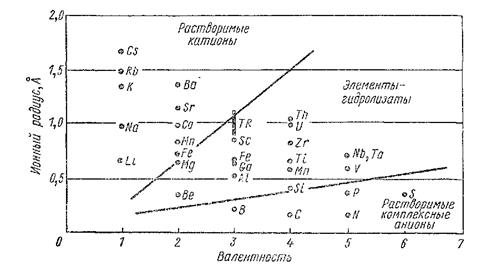
Рис. 8.2. Разделение важнейших элементов по их ионным потенциалам.
ионных потенциалов, растворимых комплексных анионов с большими ионными потенциалами и, наконец, элементов- гидролизатов с промежуточными значениями ионных потенциалов. Среди элементов последней группы встречаются такие ионы, как Ti4+, Zr4+, Nb6+, которые могут концентрироваться в бокситах наряду с Ga3+ и Ве8+ с коэффициентом обогащения, равным 5, по сравнению с их материнскими породами, за счет разрушения которых шло образование бокситов.
Дата добавления: 2015-08-14; просмотров: 1667;
