Распределение молекул по скоростям
Аналогичная неравномерность имеет место и в распределении частиц в газе по скоростям. Случайный обмен импульсами и энергиями частиц при столкновениях приводит к некоторому разбросу кинетических энергий и скоростей молекул вокруг их средних значений, соответствующих установившейся в газе температуре. Случайные изменения скоростей молекул в результате столкновений можно рассматривать как случайное блуждание частиц, но не в реальном координатном пространстве, а в пространстве скоростей, осями в котором являются скорости частиц vx, vу, vz (рис.).
 Поэтому все сказанное о хаотическом тепловом движении в реальном пространстве применимо и к распределению частиц по скоростям. В частности, можно записать формулу для числа частиц, имеющих значение компоненты скорости vz в интервале между значениями vz и vz + dz в виде, аналогичном (2.16):
Поэтому все сказанное о хаотическом тепловом движении в реальном пространстве применимо и к распределению частиц по скоростям. В частности, можно записать формулу для числа частиц, имеющих значение компоненты скорости vz в интервале между значениями vz и vz + dz в виде, аналогичном (2.16):
 ,
,
где теперь вместо потенциальной энергии частицы находится та часть ее кинетической анергии, которое связана с движением вдоль оси Z, а величина A — некоторая размерная константа.
Поскольку движения в направлениях x, y и z равноправны, распределения частиц со скоростями в этих направлениях описываются такими же выражениями. Тот факт, что частица обладает каким-либо значением скорости v, представляет собой случайное событие, состоящее из трех независимых случайных событий — определенных значений компонент скоростей vх, vу, vz. Поэтому число частиц, обладающих заданным значением полной скорости v, определяется произведением вероятностей указанных случайных событий
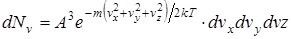 . (2.18)
. (2.18)
Окончательно распределение частиц в газе по скоростям имеет вид:
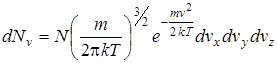 . (2.19)
. (2.19)
Это выражение называется распределением Максвелла. Можно получить выражение для числа частиц в газе, обладающих заданной величиной скорости. Для этого формулу (2.19) нужно просуммировать по всем частицам, различающимся компонентами скорости vх, vу, vz, но обладающими одинаковой абсолютной величиной v. Это суммирование можно произвести так.
Рассмотрим произведение dvхdvуdvz, входящее в формулу (2.19). Оно представляет собой бесконечно малый элемент объема в пространстве скоростей (рис.)
 Состояния с различными проекциями скоростей vх, vу, vz, но с одинаковой величиной v будут заполнять шаровой слой, объем которого равен 4πv2dv. Заменив, таким образом, в формуле (2.19) элемент объема на элемент шарового слоя, найдем распределение Максвелла по абсолютным величинам скоростей:
Состояния с различными проекциями скоростей vх, vу, vz, но с одинаковой величиной v будут заполнять шаровой слой, объем которого равен 4πv2dv. Заменив, таким образом, в формуле (2.19) элемент объема на элемент шарового слоя, найдем распределение Максвелла по абсолютным величинам скоростей:

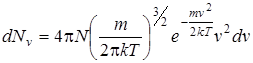 . (2.20)
. (2.20)
Функция 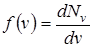 , определяемая выражением (2.20), представляет собой плотность вероятности того, что частицы имеют заданное значение абсолютной величины скорости. Приравнивая нулю производную от нее по v, можно найти положение максимума этой функции. Графически функция представлена на рис.
, определяемая выражением (2.20), представляет собой плотность вероятности того, что частицы имеют заданное значение абсолютной величины скорости. Приравнивая нулю производную от нее по v, можно найти положение максимума этой функции. Графически функция представлена на рис.
 Видно, что наиболее вероятная величина скорости в газе — скорость vm.
Видно, что наиболее вероятная величина скорости в газе — скорость vm.
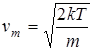 .
.
Она немного отличается от введенной ранее средней тепловой скорости (2.4). Видно также, что вероятность частиц иметь скорость, равную нулю, или, наоборот, иметь бесконечную скорость равна нулю. Следовательно, наибольшее число частиц имеет близкие значения скоростей вблизи скорости vm. Функция распределения Максвелла позволяет вычислить все представляющие физический интерес средние характеристики газа, например, величину средней скорости
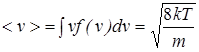 , (2.21)
, (2.21)
и величину среднеквадратичной скорости:
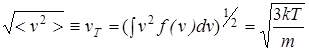 .
.
которая была введена ранее. Все эти средние скорости близки друг другу.
Дата добавления: 2015-08-08; просмотров: 824;
