Понятие о методе молекулярных орбиталей
Для описания химической связи используются два подхода. Один из них – это теория молекулярных орбиталей (МО), другой теория валентных связей (ВС). В развитии теории ВС основополагающую роль сыграли работы Гейтлера, Лондона, Слетера, Полинга, а в развитии теории МО – работы Малликена и Гунда.
В теории МО молекула рассматривается как совокупность положительно заряженных ядер и отрицательно заряженных электронов, каждый из которых движется в поле остальных электронов и всех ядер. Каждая молекула имеет свою молекулярную орбиталь. Молекулярная орбиталь – есть комбинация атомных орбиталей. Известно, что электрон находится в связывающей или разрыхляющей областях молекулы. Поэтому различают связывающие и разрыхляющие молекулярные орбитали. В связывающей молекулярной орбитали электронная плотность концентрируется между ядрами, в разрыхляющей молекулярной орбитали за ядрами. Для упрощения рассмотрим образование молекулярных орбиталей двухатомной молекулы. При сближении двух изолированных атомов их атомные орбитали перекрываются. Из каждых двух перекрывающихся атомных орбиталей образуются две молекулярные орбитали: одна связывающая и одна разрыхляющая. Если орбитали атомов А и В, образующих молекулу АВ, обозначить через ψА и ψВ, то их возможные комбинации имеют вид
ψ+ = с1ψА + с2ψВ; ψ- = с3ψА – с4ψВ (5).
Здесь коэффициенты сi обозначают долю участия, соответствующих атомных орбиталей в формировании молекулярных; ψ+ - связывающая, а ψ- - разрыхляющая молекулярные орбитали.
Если коэффициент сi близок к нулю, то это означает, что пребывание электрона в области, описываемой данной АО маловероятно.
Представление молекулярной орбитали в виде линейной комбинации атомных орбиталей (ЛКАО) получило название приближения МО ЛКАО. В приближении МО ЛКАО всегда образуется столько молекулярных орбиталей, сколько было исходных АО электронов всех ядер. Таким образом, количество молекулярных орбиталей равно суммарному количеству атомных орбиталей. Например, для молекулы Н2 общее количество АО равно двум, поэтому образуются только две МО. В случае молекулы О2 необходимо рассматривать 10 МО, так как в их образовании участвуют 1s-, 2s-, 2px-, 2py-, 2pz- атомных орбиталей, всего по 5 АО от каждого атома.
Молекулярные орбитали обозначают греческими буквами (π, σ), причем со звездочкой для разрыхляющей орбитали (π*, σ*). Молекулярные орбитали, образованные перекрыванием атомных орбиталей по оси расположения атомных ядер, называются σ-орбиталями. Данные МО являются симметричными относительно вращения вокруг межъядерной оси.
π-орбитали – это МО, антисимметричные относительно вращения вокруг межъядерной оси. МО π –симметрии образуются при особом перекрывании p-, d-, f- АО.
δ –орбитали – это МО, антисимметричные относительно отражения в двух взаимно перпендикулярных плоскостях, проходящих через межъядерную ось. Данные орбитали образуются при особом перекрывании d- и f- АО.
Энергия σ-, π-, δ- орбиталей уменьшается в следующей последовательности
σ > π > δ.
Образование МО из АО изображают в виде энергетической диаграммы (рис. 17), где по вертикали откладывают значения энергии Е орбиталей. Слева и справа на диаграмме приводят энергетические уровни атомных орбиталей, в середине – уровни молекулярных орбиталей.
Связывающая молекулярная орбиталь характеризуется повышенной электронной плотностью в пространстве между ядрами, поэтому такая орбиталь энергетически более выгодна, чем атомные орбитали. Вследствие этого уровень энергии связывающей орбитали на диаграмме расположен ниже уровня исходных атомных орбиталей. На разрыхляющей орбитали электронная плотность концентрируется за ядрами и поэтому подобная орбиталь энергетически менее выгодна, чем исходные атомные орбитали. Энергетическое положение разрыхляющих орбиталей на диаграмме находится выше уровня исходных атомных орбиталей.
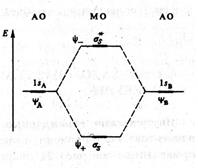
Рис. 17. Энергетическая диаграмма 1s - атомных и молекулярных
орбиталей двухатомной гомоядерной молекулы.
Переход электронов с атомных 1s-орбиталей на связывающую МО, приводящий к возникновению химической связи, сопровождается выделением энергии. Переход электронов с атомных 1s-орбиталей на разрыхляющую МО требует затрат энергии. Приближенно можно считать, что при переходе 1S-электрона на связывающую МО выделяется столько же энергии, сколько необходимо затратить для его перевода на разрыхляющую МО.
Положение исходной АО на шкале энергий определяется значением энергии ионизации атома, отвечающей удалению электрона, описываемого данной орбиталью, на бесконечно большое расстояние. Такая энергия ионизации называется орбитальной энергией ионизации. Для атома кислорода возможные типы ионизации определяются удалением электрона с 2p- и 2s- электронной подоболочки. Удаление 2p- электрона требует затраты энергии 13,61 эВ, а удаление 2s-электрона – 28,46 эВ. Поэтому 2р-AО кислорода на энергетических диаграммах отмечается уровнем энергии -13,61 эВ, а 2s-АО – уровнем энергии -28,46 эВ.
Положение МО на энергетических диаграммах определяется на основании квантово-химических расчетов электронной структуры молекул. Для сложных молекул число энергетических уровней МО на энергетических диаграммах велико. Однако часто необходимо знать энергии не всех молекулярных орбиталей, а только наиболее чувствительных к внешним воздействиям. Такими орбиталями являются МО, на которых размещены электроны самых высоких энергий. Эти электроны наиболее легко удаляются с данной МО, например, под действием излучения. Такая МО получила название высшая занятая молекулярная орбиталь (ВЗМО). Зная число молекулярных орбиталей, которое равно суммарному числу всех АО, и зная число электронов, можно легко определить порядковый номер ВЗМО и, соответственно, её энергию и состав. Кроме того, наиболее важной для изучения химических задач является низшая свободная молекулярная орбиталь (НСМО). Данная орбиталь является вакантной, и она следующая по очереди за ВЗМО на шкале энергий.
Дата добавления: 2015-08-08; просмотров: 2337;
