Типы связей.
В химии различают следующие типы связей: ковалентная, ионная, металлическая, водородная связь, связь Ван-дер-Ваальса, донорно-акцепторная связь, дативная связь.
Ковалентная связь
При образовании ковалентной связи атомы делятся друг с другом электронами. Примером ковалентной связи является химическая связь в молекуле Cl2. Впервые Льюис (1916 г.) предположил, что в такой связи каждый из двух атомов хлора делится одним из своих внешних электронов с другим атомом хлора. Для перекрывания атомных орбиталей два атома должны подойти друг к другу как можно ближе. Общая пара электронов образует ковалентную связь. Эти электроны занимают одну и туже орбиталь, а их спины направлены в противоположные стороны.
Таким образом, ковалентная связь осуществляется обобществлением электронов от разных атомов в результате спаривания электронов с противоположными спинами.
Ковалентная связь является широко распространенным типом связи. Ковалентная связь может возникать не только в молекулах, но и кристаллах. Она возникает между одинаковыми атомами (в молекулах Н2, Cl2, алмазе) и между разными атомами (в молекулах Н2О, NH3…)
Механизм возникновения ковалентной связи
Механизм рассмотрим на примере образования молекулы Н2.
Н+Н=Н2, ∆Н=-436 кДж/моль
Ядро свободного атома водорода окружено сферически симметричным электронным облаком, образованным 1s-электроном. При сближении атомов до определенного расстояния, происходит частичное перекрывание их электронных облаков (орбиталей) (рис. 4 ).
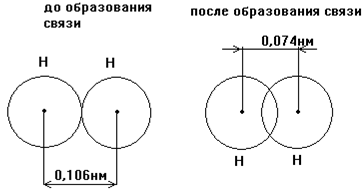
Рис. 4. Механизм образования связи в молекуле водорода.
Если у сблизившихся до касания атомов водорода расстояние между ядрами 0,106 нм, то после перекрывания электронных облаков, это расстояние составляет 0,074 нм.
В результате между центрами ядер возникает молекулярное двухэлектронное облако, обладающее максимальной электронной плотностью в пространстве между ядрами. Увеличение плотности отрицательного заряда между ядрами благоприятствует сильному возрастанию сил притяжения между ядрами, что приводит к выделению энергии. Химическая связь тем прочнее, чем больше перекрывание электронных орбиталей. В результате возникновения химической связи между двумя атомами водорода каждый из них достигает электронной конфигурации атома благородного газа - гелия.
Существует два метода, объясняющих с квантово-механических позиций образование области перекрытия электронных облаков, и образования соответственно ковалентной связи. Один из них называется метод ВС (валентных связей), другой МО (молекулярных орбиталей).
В методе валентных связей рассматривается перекрывание атомных орбиталей выделенной пары атомов. В методе МО молекулу рассматривают как целое и распределение электронной плотности (от одного электрона) размазано по всей молекуле. С позиции МО 2Н в Н2 связаны за счет притяжения ядер к электронному облаку, расположенному между этими ядрами.
Изображение ковалентной связи
Связи изображают по-разному:
1). С помощью электронов в виде точек
В этом случае образование молекулы водорода показывают схемой
Н∙ + Н∙ → Н : Н
2). С помощью квадратных ячеек (орбиталей), как размещение двух электронов с противоположными спинами в одной молекулярной квантовой ячейке
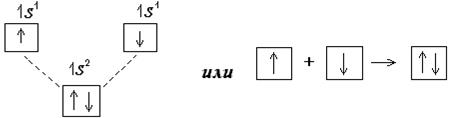
Эта схема показывает, что молекулярный энергетический уровень ниже исходных атомных уровней, а значит молекулярное состояние вещества более устойчивое, чем атомное.
3). Ковалентную связь изображают чертой
Например, Н – Н. эта черта символизирует пару электронов.
Если между атомами возникла одна ковалентная связь (одна общая электронная пара), то она называется одинарной, если больше, то кратной двойной (две общие электронные пары), тройной (три общие электронные пары). Одинарная связь изображается одной чертой, двойная – двумя, тройная – тремя.
Черточка между атомами показывает, что у них пара электронов обобщена.
Классификация ковалентных связей
В зависимости от направления перекрывания электронных облаков различают σ-, π-, δ-связи. σ-связь возникает при перекрывании электронных облаков вдоль оси, соединяющей ядра взаимодействующих атомов.
Примеры σ-связи:
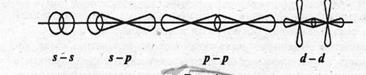
Рис. 5. Образование σ-связи между s-, p-, d- электронами.
Пример образования σ-связи при перекрывании s-s-облаков наблюдается в молекуле водорода.
π-связь осуществляется при перекрывании электронных облаков по обе стороны от оси, соединяющий ядра атомов.

Рис. 6. Образование π-связи между p-, d- электронами.
δ- связь возникает при перекрывании двух d-электронных облаков, расположенных в параллельных плоскостях. δ-связь менее прочная, чем π-связь, а π-связь менее прочная чем σ-связь.
Свойства ковалентной связи
а). Полярность.
Различают две разновидности ковалентной связи: неполярную и полярную.
В случае неполярной ковалентной связи электронное облако, образованное общей парой электронов, распределяется в пространстве симметрично относительно ядер атомов. Примером являются двухатомные молекулы, состоящие из атомов одного элемента: Н2, Cl2, О2, N2, F2. У них электронная пара в одинаковой мере принадлежит обоим атомам.
В случае полярной связи электронное облако, образующее связь, смещено к атому с большей относительной электроотрицательностью.
Примерами являются молекулы: НCl, Н2О, Н2S, N2S, NH3 и др. Рассмотрим образование молекулы HCl, которое можно представить следующей схемой
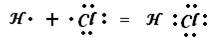
Электронная пара смещена к атому хлора, т.к. относительная электроотрицательность атома хлора (2,83) больше, чем атома водорода (2,1).
б). Насыщаемость.
Способность атомов участвовать в образовании ограниченного числа ковалентных связей называется насыщаемостью ковалентной связи. Насыщаемость ковалентных связей обусловлена тем, что в химическом взаимодействии участвуют электрона только внешних энергетических уровней, то есть ограниченное число электронов.
в). Направленность и гибридизация ковалентной связи.
Ковалентная связь характеризуется направленностью в пространстве. Это объясняется тем, что электронные облака имеют определенную форму и их максимальное перекрывание возможно при определенной пространственной ориентации.
Направленность ковалентной связи определяет геометрическое строение молекул.
Например, для воды она имеет треугольный вид.
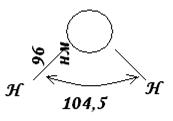
Рис. 7. Пространственная структура молекулы воды.
Экспериментально установлено, что в молекуле воды H2O расстояние между ядрами водорода и кислорода составляет 0,096 нм (96 пм). Угол между линиями, проходящими через ядра, составляет 104,50 . Таким образом, молекула воды имеет угловую форму и ее строение можно выразить в виде представленного рисунка.
Гибридизация
Как показывают экспериментальные и теоретические исследования (Слейтер, Полинг) при образовании некоторых соединений, таких как BeCl2, BeF2, BeBr2 состояние валентных электронов атома в молекуле описываются не чистыми s-, p-, d- волновыми функциями, а их линейными комбинациями. Такие смешанные структуры называются гибридными орбиталями, а процесс смешивания гибридизацией.
Как показывают квантово-химические расчеты смешивание s- и p- орбиталей атома – процесс благоприятный для образования молекулы. В этом случае выделяется больше энергии, чем при образовании связей с участием чистых s- и p- орбиталей. Поэтому гибридизация электронных орбиталей атома приводит к большому понижению энергии системы и соответственно повышению устойчивости молекулы. Гибридизированная орбиталь отличается большей вытянутостью по одну сторону от ядра, чем по другую. Поэтому электронная плотность в области перекрывания гибридного облака будет больше электронной плотности в области перекрывания отдельно s- и p- орбиталей, вследствие чего связь, образованная электронами гибридной орбитали, характеризуется большей прочностью.
Имеют место несколько типов гибридных состояний. При гибридизации s- и p- орбиталей (называется sp-гибридизация), возникают две гибридные орбитали, расположенные относительно друг друга под углом 1800. В этом случае образуется линейная структура. Такая конфигурация (структура) известна для большинства галогенидов щелочноземельных металлов (например, ВеX2, где X=Cl, F, Br), т.е. 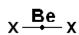 угол связи равен 1800С.
угол связи равен 1800С.
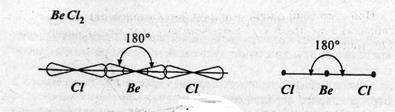
Рис. 8. sp-гибридизация
Другой тип гибридизации, называемый sp2-гибридизацией (образуется из одной s и двух p-орбиталей), приводит к образованию трех гибридных орбиталей, которые располагаются друг к другу под углом 1200. При этом в пространстве образуется тригональная структура молекулы (или правильного треугольника). Такие структуры известны для соединений ВX3 (X=Cl, F, Br).
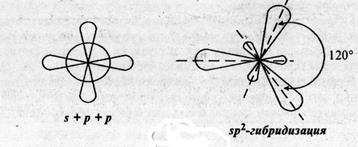
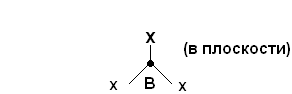
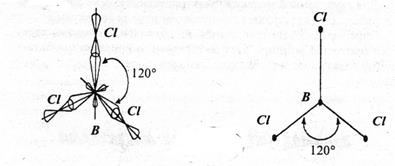
Рис. 9. sp2-гибридизация.
Не менее часто встречается sp3-гибридизация, которая образуется из одного s- и трех p- орбиталей. При этом образуется четыре гибридные орбитали ориентированные в пространстве симметрично четырем вершинам тетраэдра, то есть они расположены под углом 109028'. Такое пространственное положение называется тетраэдрическим. Такая структура известна для молекул NH3, Н2О и вообще для элементов II периода. Схематично её вид в пространстве можно отобразить следующим рисунком
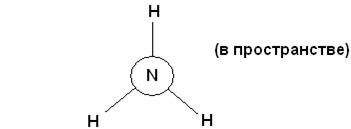
Рис. 10. Пространственное расположение связей в молекуле аммиака,
спроецированное на плоскость.
Образование тетраэдрических связей за счет sp3-гибридизации можно представить в виде следующего (рис. 11):
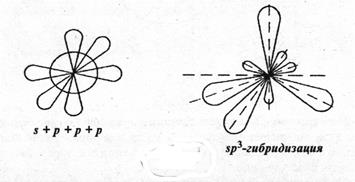
Рис. 11. Образование тетраэдрических связей при sp3-гибридизации.
Образование тетраэдрических связей при sp3 – гибридизации на примере молекулы CCl4 представлено на рис. 12.
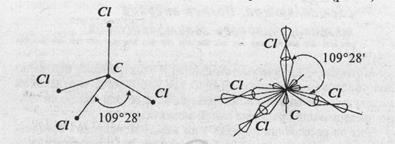
Рис.12. Образование тетраэдрических связей при sp3 – гибридизации в молекулы CCl4
Гибридизация касается не только s- и p-орбиталей. Для объяснения стереохимических элементов III и последующих периодов возникает необходимость в построении гибридных орбиталей одновременно включающих s-, p-, d- орбитали.
К веществам с ковалентной связью относятся:
1. органические соединения;
2. твердые и жидкие вещества, у которых связи образуются между парами атомов галогенов, а также между парами атомов водорода, азота и кислорода, например, Н2;
3. элементы VI группы (например, спиральные цепочки теллура), элементы V группы (например, мышьяк), элементы IV группы (алмаз, кремний, германий);
4. соединения, подчиняющиеся правилу 8-N (такие как InSb, CdS, GaAs, CdTe), когда образующие их элементы расположены в периодической таблице Менделеева в II-VI, III-V группах.
В твердых телах с ковалентной связью могут для одного и того же вещества образовываться различные кристаллические структуры, энергия связи которых практически одинакова. Например, структура ZnS может быть кубической (цинковая обманка) или гексагональной (вюрцит). Расположение ближайших соседей в цинковой обманке и вюрците одинаково, а единственное и небольшое отличие в энергиях этих двух структур определяется расположением атомов, следующих за ближайшими. Подобная способность некоторых веществ называется аллотропией или полиморфизмом. Другим примером аллотропии является карбид кремния, который имеет целый ряд полититпов различной структуры от чисто кубической до гексагональной. Эти многочисленные кристаллические модификации ZnS, SiC существуют при комнатной температуре.
Ионная связь
Ионная связь представляет собой электростатическую силу притяжения между ионами с зарядами противоположного знака (т.е. + и −).
Представление об ионной связи сформировалось на основе идей В.Косселя. Он предположил (1916 г.), что при взаимодействии двух атомов один их них отдает, а другой принимает электроны. Таким образом, ионная связь образуется в результате переноса одного или нескольких электронов от одного атома к другому. Например, в хлориде натрия ионная связь образуется в результате переноса электрона от атома натрия к атому хлора. Вследствие такого переноса образуется ион натрия с зарядом +1 и ион хлора с зарядом -1. Они притягиваются друг к другу электростатическими силами, образуя устойчивую молекулу. Модель электронного переноса, предложенная Косселем, позволяет объяснить образование таких соединений как фторид лития, оксид кальция, оксид лития.
Наиболее типичные ионные соединения состоят из катионов металлов, принадлежащих к I и II группам периодической системы, и анионов неметаллических элементов, принадлежащих к VI и VII группам.
Легкость образования ионного соединения зависит от легкости образования входящих в него катионов и анионов. Легкость образования тем выше, чем меньшую энергию ионизации имеет атом, отдающий электроны (донор электронов), а атом, присоединяющий электроны (акцептор электронов), обладает большим сродством к электрону. Сродство к электрону – это мера способности атома присоединять электрон. Её количественно определяют как изменение энергии, происходящее при образовании одного моля однозарядных анионов из одного моля атомов. Это так называемое понятие «первое сродство к электрону». Второе сродство к электрону – это изменение энергии, происходящее при образовании одного моля двухзарядных анионов из одного моля однозарядных анионов. Данные понятия, то есть энергия ионизации и сродство к электрону, относятся к газообразным веществам и являются характеристиками атомов и ионов в газообразном состоянии. Но следует иметь в виду, что большинство ионных соединений наиболее устойчивы в твердом состоянии. Данное обстоятельство объясняется существованием у них в твердом состоянии кристаллической решетки. Возникает вопрос. Почему же все-таки ионные соединения более устойчивы в виде кристаллических решеток, а не в газообразном состоянии? Ответом на этот вопрос служит расчет энергии кристаллической решетки, основанный на электростатической модели. В дополнении к этому данный расчет является и проверкой теории ионной связи.
Для расчета энергии кристаллической решетки необходимо определить работу, которую нужно затратить на разрушение кристаллической решетки с образованием газообразных ионов. Для проведения расчета используется представление о силах притяжения и отталкивания. Выражение для потенциальной энергии взаимодействия однозарядных ионов получается суммированием энергии притяжения и энергии отталкивания
Е = Еприт + Еотт (1).
В качестве Еприт берется энергия кулоновского притяжения ионов разноименных знаков, например, Na+ и Cl- для соединения NaCl
Еприт = -е2/4πε0 r (2),
поскольку распределение электронного заряда в заполненной электронной оболочке сферически-симметрично. Благодаря отталкиванию, возникающему вследствие принципа Паули при перекрытии заполненных оболочек аниона и катиона, расстояние, на которое могут сблизиться ионы, ограниченно. Энергия отталкивания быстро изменяется с межъядерным расстоянием, и её можно записать в виде следующих двух приближенных выражений:
Еотт = А/rn (n≈12) (3)
или
Еотт = В∙ехр(-r/ρ) (4),
где А и В – константы, r-расстояние между ионами, ρ - параметр (характерная длина).
Следует заметить, что ни одно из этих выражений не соответствует сложному квантово-механическому процессу, который приводит к отталкиванию.
Несмотря на приближенность данных формул, они позволяют достаточно точно рассчитать и соответственно описать химическую связь в молекулах таких ионных соединений, как NaCl, KCl, CaO.
Так как электрическое поле иона имеет сферическую симметрию (рис. 13), то ионная связь в отличие от ковалентной не обладает направленностью. Взаимодействие двух противоположно заряженных ионов компенсируется силами отталкивания только в направлении, соединяющим центры ядер ионов, в других направлениях компенсация электрических полей ионов не происходит. Поэтому они способны взаимодействовать и с другими ионами. Таким образом, ионная связь не обладает насыщаемостью.
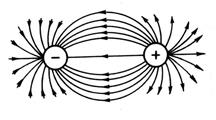
Рис. 13. Сферическая симметрия электростатического поля
разноименнозаряженных зарядов.
Вследствие ненаправленности и ненасыщаемости ионной связи энергетически наиболее выгодно, когда каждый ион окружен максимальным числом ионов противоположного знака. Благодаря этому наиболее предпочтительная форма существования ионного соединения – кристалл. Например, в кристалле NaCl каждый катион имеет в качестве ближайших соседей шесть анионов.
Только при высоких температурах в газообразном состоянии ионные соединения существуют в виде неассоциированных молекул.
В ионных соединениях координационное число не зависит от специфики электронной структуры атомов, как в ковалентных соединениях, а определяется соотношением размеров ионов. При соотношении ионных радиусов в пределах 0,41 – 0,73 наблюдается октаэдрическая координация ионов, при соотношении 0,73-1,37 – кубическая координация и т.д..
Таким образом, в обычных условиях ионные соединения представляют собой кристаллические вещества. Понятие двухионных молекул, например, NaCL, CsCl к ним не применимо. Каждый кристалл состоит из большого числа ионов.
Ионную связь можно представить как предельную полярную связь, для которой эффективный заряд атома близок к единице. Для чисто ковалентной неполярной связи эффективный заряд атомов равен нулю. В реальных веществах чисто ионных и чисто ковалентных связей встречается мало. Большинство соединений имеет характер связи промежуточный между неполярной ковалентной и полярной ионной. То есть в данных соединениях ковалентная связь имеет частично ионный характер. Характер ионной и ковалентной связи в реальных веществах представлен на рисунке 14.
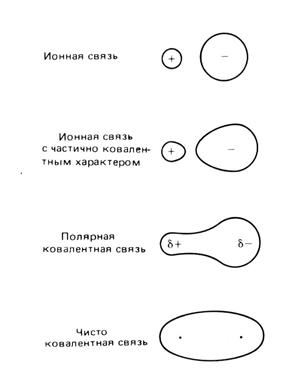
Рис. 14. Ионный и ковалентный характер связи.
Долю ионного характера связи называют степенью ионности. Она характеризуется эффективными зарядами атомов в молекуле. Степень ионности возрастает с увеличением разности электроотрицательностей образующих её атомов.
Металлическая связь
В атомах металлов внешние валентные электроны удерживаются значительно слабее, чем в атомах неметаллов. Это обуславливает потерю связи электронов с отдельными атомами на достаточно большой промежуток времени и их обобществление. Образуется обобществленный ансамбль из внешних электронов. Существование подобной электронной системы приводит к возникновению сил, которые удерживают положительные ионы металла в сближенном состоянии, несмотря на их одноименную заряженность. Такая связь называется металлической. Подобная связь характерна только для металла и существует в твердом и жидком состоянии вещества. Металлическая связь является одним из видов химической связи. Она основана на обобществлении внешних электронов, которые теряют связь с атомом и поэтому называются свободными электронами (рис. 15).
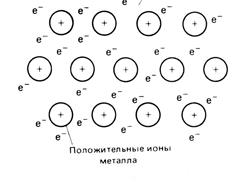
Рис. 15. Металлическая связь.
Подтверждением существования металлической связи являются следующие факты. Все металлы имеют высокую теплопроводность и высокую электропроводность, которая обеспечивается за счет наличия свободных электронов. Кроме того, это же обстоятельство определяет хорошую отражательную способность металлов к световому облучению, их блеск и непрозрачность, высокую пластичность, положительный температурный коэффициент электросопротивления.
Стабильность кристаллической решетки металлов невозможно объяснить такими видами связи как ионная и ковалентная. Ионная связь между атомами металла, находящихся в узлах кристаллической решетки, невозможна, так как они имеют один и тот же заряд. Ковалентная связь между атомами металла также маловероятна, поскольку каждый атом имеет от 8 до 12 ближайших соседей, а образование ковалентных связей с таким количеством обобществленных пар электронов неизвестно.
Металлические структуры характеризуются тем, что они имеют довольно редкое расположение атомов (межъядерные расстояния большие) и большое число ближайших соседей у каждого атома в кристаллической решетке. В таблице 1 указаны три типичные металлические структуры.
Таблица 1
Характеристики структур трех наиболее распространенных металлов
| Кристаллическая структура | Металл | Число ближайших соседей | Межъядерное расстояние, R0 |
| Обьемно-центрированная кубическая | Литий | 8 атомов на расстоянии R0;
6 атомов на расстоянии 2 R0/ 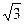
| 0,304 нм |
| Гранецентрированная кубическая (или кубическая плотноупакованная) | Медь | 12 атомов на расстоянии R0 | 0,256 нм |
| Гексагональная плотноупакованная | Цинк | 12 атомов на расстоянии R0 | 0,266 нм |
Видим, что каждый атом участвует в образовании большого числа связей (например, с 8 атомами). Столь большое число связей (с 8 или с 12 атомами) не может быть одновременно локализованы в пространстве. Связь должна осуществляться за счет резонанса колебательного движения внешних электронов каждого атома, в результате которого происходит коллективизация всех внешних электронов кристалла с образованием электронного газа. Во многих металлах для образования металлической связи достаточно взять по одному электрону от каждого атома. Именно это наблюдается для лития, у которого на внешней оболочке имеется всего один электрон. Кристалл лития представляет собой решетку ионов Li+ (шаров радиусом 0,068 нм), окруженных электронным газом.
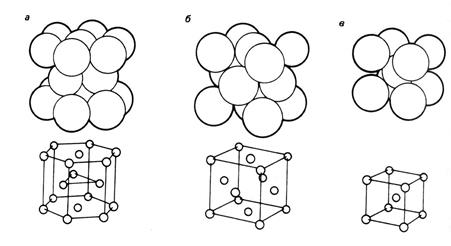
Рис. 16. Различные типы кристаллической упаковки: а-гексагональная плотная упаковка; б- гранецентрированная кубическая упаковка; в-объёмноцентрированная кубическая упаковка.
Между металлической и ковалентной связью имеется сходство. Оно заключается в том, что оба типа связи основаны на обобществлении валентных электронов. Однако ковалентная связь соединяет только два соседних атома, и общие электроны находятся в непосредственной близости от соединенных атомов. В металлической связи несколько атомов участвуют в обобществлении валентных электронов.
Таким образом, понятие металлической связи неразрывно связано с представлением о металлах как совокупности положительно заряженных ионных остовов с большими промежутками между ионами, заполненными электронным газом, при этом на макроскопическом уровне система остается электрически нейтральной.
Кроме вышерассмотренных типов химической связи существуют и другие типы связи, которые являются межмолекулярными: водородная связь, вандерваальсово взаимодействие, донорно-акцепторное взаимодействие.
Донорно-акцепторное взаимодействие молекул
Механизм образования ковалентной связи за счет двухэлектронного облака одного атома и свободной орбитали другого называется донорно-акцепторным. Атом или частица, предоставляющие для связи двухэлектронное облако называется донором. Атом или частица со свободной орбиталью, принимающие эту электронную пару называется акцептором.
Основные виды межмолекулярного взаимодействия. Водородная связь
Между молекулами, валентно-насыщенными, на расстояниях, превышающих размеры частиц, могут проявляться электростатические силы межмолекулярного притяжения. Их называют силы Ван-дер-Ваальса. Вандерваальсово взаимодействие всегда существует между близко расположенными атомами, но играет важную роль лишь в отсутствие более сильных механизмов связи. Это слабое взаимодействие с характерной энергией 0,2 эВ/атом имеет место между нейтральными атомами и между молекулами. Название взаимодействия связывается с именем Ван-дер-Ваальса, поскольку именно он впервые предположил, что уравнение состояния с учетом слабого взаимодействия между молекулами газа описывает свойства реальных газов много лучше, чем уравнение состояния идеального газа. Однако природа этой силы притяжения была объяснена лишь в 1930 году Лондоном. В настоящее время к Ван-дер-Ваальсову притяжению относят следующие три типа взаимодействий: ориентационное, индукционное, дисперсион-ное(эффект Лондона). Энергия Ван-дер-Ваальсова притяжения определяется суммой ориентационного, индукционного и дисперсионного взаимодействий.
Еприт = Еор +Еинд + Едисп (5).
Ориентационное взаимодействие (или диполь-дипольное взаимодействие) проявляется между полярными молекулами, которые при приближении поворачиваются (ориентируются) друг к другу разноименными полюсами так, чтобы потенциальная энергия системы молекул стала минимальной. Энергия ориентационного взаимодействия тем существеннее, чем больше дипольный момент молекул μ и меньше расстояние l между ними:
Еор = -(μ1μ2)2/ (8π2 ∙ε0 ∙l6) (6),
где ε0 – электрическая постоянная.
Индукционное взаимодействие связано с процессами поляризации молекул окружающими диполями. Оно тем значительнее, чем выше поляризуемость α неполярной молекулы и больше дипольный момент μ полярной молекулы
Еинд = -(αμ2)/ (8π2 ∙ε0 ∙l6) (7).
Поляризуемость α неполярной молекулы называется деформационной, так как она связана с деформацией частицы, при этом μ характеризует смещение электронного облака и ядер относительно прежних положений.
Дисперсионное взаимодействие (эффект Лондона) возникает у любых молекул независимо от их строения и полярности. Вследствие мгновенного несовпадения центров тяжести зарядов электронного облака и ядер образуется мгновенный диполь, который индуцирует мгновенные диполи в других частицах. Движение мгновенных диполей становится согласованным. В результате соседние частицы испытывают взаимное притяжение. Энергия дисперсионного взаимодействия зависит от энергии ионизации ЕI и поляризуемости молекул α
Едисп = - 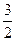 (ЕI1 ∙ЕI2)∙ α1 α2/(ЕI1 +ЕI2) l6 (8).
(ЕI1 ∙ЕI2)∙ α1 α2/(ЕI1 +ЕI2) l6 (8).
Промежуточный характер между валентным и межмолекулярным взаимодействием имеет водородная связь. Энергия водородной связи невелика 8 – 80 кДж/моль, но больше энергии взаимодействия Ван-дерВаальса. Водородная связь характерна для таких жидкостей как вода, спирты, кислоты и обусловлена положительно поляризованным атомом водорода. Малые размеры и отсутствие внутренних электронов позволяют атому водорода, присутствующему в жидкости в каком-либо соединении, вступать в дополнительное взаимодействие с ковалентно с ним не связанным отрицательно поляризованным атомом другой или той же самой молекулы
Аδ- - Нδ+ …. Аδ- - Нδ+.
То есть происходит ассоциация молекул. Ассоциация молекул приводит к уменьшению летучести, повышению температуры кипения и теплоты испарения, увеличению вязкости и диэлектрической проницаемости жидкостей.
Вода особенно подходящее вещество для образования водородной связи, так как её молекула имеет два атома водорода и две неподелённые пары у атома кислорода. Это обуславливает высокий дипольный момент молекулы (μD = 1,86 D) и способность образовывать четыре водородные связи: две – как донор протонов и две – как акцептор протонов
( Н2О….Н – О…Н2О )2 раза.
Из экспериментов известно, что с изменением молекулярной массы в ряду водородных соединений элементов третьего и последующего периодов температура кипения растет. Если данную закономерность применить к воде, то температура кипения у неё должна быть не 100 0С, а 280 0С. Данное противоречие подтверждает существование водородной связи в воде.
Эксперименты показали, что в воде формируются молекулярные ассоциаты в жидкой и особенно в твердой воде. Лед имеет тетраэдрическую кристаллическую решетку. В центре тетраэдра расположен атом кислорода одной молекулы воды, в четырех вершинах находятся атомы кислорода соседних молекул, которые соединены водородными связями с ближайшими соседями. В жидкой воде водородные связи частично разрушены, в её структуре наблюдается динамическое равновесие между ассоциатами молекул и свободными молекулами.
Дата добавления: 2015-08-08; просмотров: 5276;
