Строение твердого тела. Виды связей.
Возможность реализации твердого состояния вещества обусловлена, существованием сил взаимодействия между структурными частицами, при их сближении на достаточно малое расстояние. Такими частицами могут быть атомы, ионы или молекулы. Для возникновения устойчивой структуры твердого тела необходимо существование сил двоякого рода: силы притяжения, препятствующие удалению частиц друг от друга на большие расстояния, и силы отталкивания, препятствующие их слиянию. Различие между силами внутри кристаллической связи тесно связано с различием механических, электрических магнитных и других физических свойств вещества. Однако при этом во всех типах кристаллов взаимодействия обуславливающие связи почти всегда сводится к обычному кулоновскому электростатическому взаимодействию между зарядами, а именно притяжению между отрицательными зарядами электронов и положительными зарядами ядер, таким образом, различие типов связи в кристаллах является неразличием в природе взаимодействия, а количественное различие в распределении электронного заряда. Распределение электронного заряда в принципе может быть определено в рамках квантовой механики, т.е. путем решения уравнение Шредингера. Наиболее общим видом связи возникающим между любыми атомами, молекулами являются силы Вандервальса впервые предложенные при обосновании уравнения состояния реального газа Вандервальса
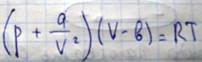
В кристаллах, в которых связь осуществляется за счет сил Ван-дер-Ваальса называется молекулярные кристаллы. Почти в чистом виде силы Вандервальса действуют между молекулами с насыщенными химическими связями, а также между атомами инертных газов (гелий аргон ксенон криптон) обуславливая существования их жидкого и тверд0го состояния. В общем случае связь Вандервальса включает дисперсионное ориентационное и индукционное взаимодействие. Рассмотрим дисперсионное взаимодействие на примере взаимодействия двух атомов гелия
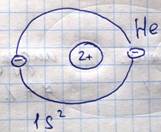
На s оболочке гелия находится два электрона, поэтому электронная плотность атома гелия обладает сферической симметрией вследствие чего его электрический или дипольный момент равен нулю, это лишь означает, что равно нулю среднее значение электрического момента атома
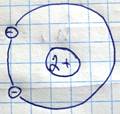
В каждый момент времени электроны располагаются вполне определенных местах пространства создавая мгновенные быстро меняющиеся диполи. При сближении двух атомов гелия движение электронов устанавливается корреляция, которая и приводит к возникновению сил взаимодействия, причем эти силы могут быть двоякого рода. При сближении двух атомов гелия энергия системы понижается, т.е. эта конфигурация является более вероятной и осуществляется наиболее часто, это и приводит к возникновению сил притяжения объясняющих существования жидкой и твердой фазы гелия. Свое название эти силы получили вследствие того что энергия дисперсионного взаимодействия зависит от поляризуемости атома, который также определяет оптические свойства атомов.
Ориентационные взаимодействия сил Вандервальса: если молекулы вещества обладают постоянным дипольным моментом, то есть они являются полярными, то между ними возникает электростатическое взаимодействие стремящееся расположить молекулы в определенном порядке, приводящем к уменьшению энергии системы
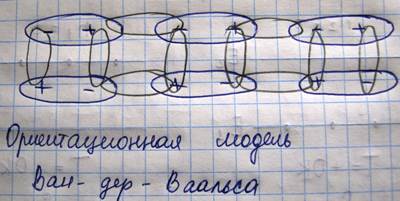
Правильная ориентация молекул нарушается тепловым движением поэтому энергия системы определяемая ориентацией молекул сильно зависит от температуры (ориентационный механизм). Индукционный механизм: если полярные молекулы образующие вещество обладают высокой поляризуемостью, то возникает дополнительный наведенный дипольный момент под действием поля постоянных диполей

В общем случае сближение двух молекул могут возникать все три вида связи и энергия взаимодействия складывается из дисперсионной индукционной и ориентационной

По порядку величины энергия Вандервальса 10^4 дж\моль.
Ионная связь
Атомы, стоящие в периодической таблице Менделеева рядом с инертным газом обладают склонностью принимать их конфигурацию, либо путем отдачи или принятия дополнительных электронов. У атомов щелочных металлов стоящих непосредственно за инертными газами валентный электрон движется вне заполненного слоя и поэтому связан с ядром слабо. У галоидов стоящих непосредственно перед инертным газом недостает одного электрона для заполнения устойчивого слоя, поэтому они обладают высоким сродством к дополнительному электрону

Поэтому связь между такого рода атомами, то есть между типичными металлами и галогенами, осуществляется следующим образом: в начале происходит перезарядка обоих атомов. Такая связь получила название ионной или полярной. Энергия притяжения ионов отстоящих друг от друга на расстоянии R
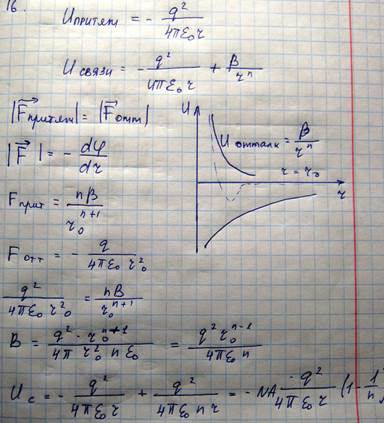
С уменьшением R энергия растет. Под действием силы притяжения ионы стремятся максимально сблизиться друг с другом, однако этому начинает препятствовать сила отталкивания, которая проявляется на очень малых расстояниях, причем она очень быстро нарастает.
Ковалентная связь
Наличием ионной связи и взаимодействием Вандервальса невозможно объяснить существование соединений типа H2, О2, Сl2. Однородные атомы не могут образовывать ионы разного знака. Поэтмоу для объяснения существования таких веществ рассматривается особый тип связи, который называется ковалентная связь или гомополярная связь. Рассмотрим природу ковалентной связи на примере образования молекулы водорода.
24.10.12
Природа возникновения ковалентной связи на примере образования молекул водорода (1). В силу того что плотность электронного облака описывающего состояния электрона в атоме очень быстро падает с увеличением расстояния, обнаружить электрон 1 у атома или электрон 2 у атома а r=50A, 1012 лет. Поэтому атомы можно рассматривать как изолированные и энергию системы, состоящую из двух атомов, принять равной 2е0, если начать сближать атомы то при этом будет возрастать вероятность перехода электронов к «чужим» ядрам возрастает при этом степень перекрытия электронных облаков и уже теряется смысл утверждать что электрон 1 относится к атому а, а электрон 2 к атому б,. Это соответствует возникновению нового состояния не свойственного системе состоящей из двух изолированных атомов. электроны в этом состоянии принадлежат одновременно двум атомам или как говорят обобществлены. Обобществление электронов сопровождается перераспределением электронной плотности пропорциональной, как известно квадрату модулю волновой функции пси квадрат, и изменению энергии системы по сравнению с суммарной энергией двух изолированных атомов
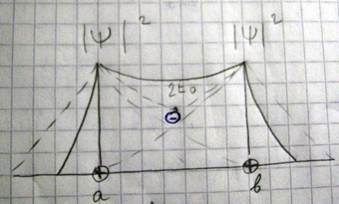
Распределение электронного облака в случае обобществления. Из данного рисунка видно, что при обобществлении электронов происходит втягивание электронных облаков в межъядерное пространство, что приводит к возникновению сил притяжения между атомов. Расчеты показали, что зависимость ориентации спинов электронов суммарная энергии системы имеет такой вид энергия молекулы

К - кулоновская энергия взаимодействия к<0, А- та самая энергия которая возникает в следствие обобществления электронов А<0. В связи с тем что уменьшение энергии системы ( при образовании молекулы водорода) происходит за счет величины А, то силу притяжения возникающей между атомами называют обменной силой или обменной связью. Характерными особенностями ковалентной связи, отличающей ее от других видов связи являются насыщенность и направленность. Насыщенность выражает то обстоятельство что каждый атом способен образовывать ковалентную связь лишь с вполне определенным числом своих соседей. Например каждый атом водорода образует связь только с одним соседом, поскольку два электрона с антипараллельными спинами согласно принципу Паули занимает одно квантовое состояние, поэтому если двум атомам водорода приблизится третий атом , то такая система не будет устойчивой. Направленный характер ковалентной связи означает что она образуется в том направлении в котором расположена наибольшая часть электронной плотности обеспечивающей при этом максимальное перекрытие электронных облаков
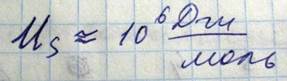
Дата добавления: 2015-08-08; просмотров: 1452;
