Водородная связь. Она возникает в том случае, когда атом водорода связан сильно электроотрицательным атомом (кислород фтор азот хлор)
Она возникает в том случае, когда атом водорода связан сильно электроотрицательным атомом (кислород фтор азот хлор), такой атом притягивает электрон связи атома водорода и приобретает отрицательный заряд атом водорода, у которого электрон оттянут, приобретает положительный заряд, и водородная связь обусловлена электростатическим притяжением этих зарядов. Типичным примеров водородной связи является связь между молекулами воды
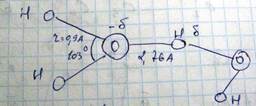
Возникновению водородной связи способствуют малые размеры атома водорода позволяющему сблизиться с электроотрицательным атомом. Водородная связь вызывает объединение (ассоциацию) молекул жидкостей (вода, кислоты, спирты) приводящую к повышению их вязкости, увеличению точки кипения, аномальному изменению объема при нагревании. Иллюстрацией к аномальным изменениям объема при нагревании является зависимость плотности воды при нагревании. Выше рассматривались силы притяжения между взаимодействующими атомами молекулы (Ван-дер-Ваальс, ионная связь, ковалентная связь, водородная связь, металлическая связь). Для существования устойчивой системы необходимо также сил отталкивания препятствующих беспредельному сближению частиц друг с другом и их полному слиянию. Источником сил отталкивания является прежде всего силы взаимодействия между ядрами. Причем это особенно справедливо для атомов легких элементов где ядро слабо экранировано электронной оболочкой. Особенно для атомов легких элементов
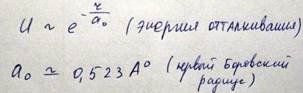
Во всех других случаях кроме легких элементов решающую роль возникновения сил отталкивания играет перекрытие электронных оболочек атомов при их сближении, приводящее к нарушению принципа Паули

Дата добавления: 2015-08-08; просмотров: 893;
