Водородная связь. 6.2.1 Общие понятия.Химическая связь, образованная положительно поляризованным водородом молекулы А—Н (или полярной группы—А-Н) и электроотрицательным
6.2.1 Общие понятия.Химическая связь, образованная положительно поляризованным водородом молекулы А—Н (или полярной группы—А-Н) и электроотрицательным атомом В другой или той же молекулы, называется водородной связью
Если водородная связь образуется между разными молекулами, она называется межмолекулярной, если связь образуется между двумя группами одной и той же молекулы, то она называется внутримолекулярной. Водородная связь между молекулами А-Н и B-R обозначается тремя точками
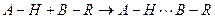 .
.
водород в данном случае образует две химические связи, причем они не равноценны.
Образование водородной связи обусловлено тем, что в полярных молекулах А-Н или полярных группах -А-Н поляризованный атом водорода обладает уникальными свойствами: отсутствием внутренних электронных оболочек, значительным сдвигом электронной пары к атому с высокой электроотрицательностью и очень малым размером. Поэтому водород способен глубоко внедряться в электронную оболочку соседнего отрицательно поляризованного атома.
Атомы А и В могут быть одинаковыми, как при взаимодействии HF
 .
.
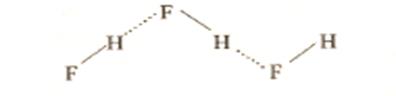
но могут быть и разными, как при взаимодействии воды и фтороводорода
6.2.2 Энергия и длина водородной связиЭнергия водородной связи возрастает с увеличением электроотрицательности (ЭО) и уменьшением размеров атомов В. Поэтому наиболее прочные водородные связи возникают, когда в качестве атомов В выступают F, О или N. Энергия связи (кДж/моль) возрастает в ряду
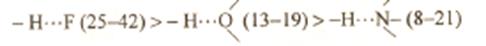
|
Несмотря на высокую ЭО у хлора, водородная связь 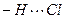 - относительно слабая из-за большого размера атома хлора.
- относительно слабая из-за большого размера атома хлора.
|
Как видно, энергия водородной связи имеет промежуточное значение между энергией ковалентной связи и вандерваальсовых сил. Также промежуточные значения имеют длины водородных связей. Так, в полимере (НF)n
длина связи F-H = 0,092 нм, а связи 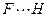 — 0,14 нм. У воды длина связи О-Н — 0,096 нм, а связи
— 0,14 нм. У воды длина связи О-Н — 0,096 нм, а связи 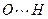 — 0,177 нм.
— 0,177 нм.

|
6.2.3 Влияние водородных связей на свойства веществПри возникновении водородных связей образуются димеры, тримеры или полимерные структуры, например зигзагообразные структуры (НF)n, кольцевые структуры некоторых органических кислот, например уксусной кислоты
или более сложные конфигурации, например у льда, у которого молекулы воды образуют по четыре водородные связи
|

Рисунок 6.2 – Температуры кипения некоторых соединений водорода
Соответственно в жидком состоянии молекулы, вступающие в водородные связи, ассоциированы, а в твердом состоянии образуют сложные кристаллические структуры.
Образование межмолекулярных водородных связей приводит к существенному изменению свойств веществ: повышению вязкости, диэлектрической постоянной, температур кипения и плавления, теплот плавления и парообразования. Например, вода, фтороводород и аммиак имеют аномально высокие температуры кипения (рисунок 6.2) и плавления. Под влиянием водородных связей изменяются химические свойства. Например, HF — слабая кислота, в то время ее аналог НСl — сильная кислота.
6.2.4 Внутримолекулярные водородные связи Водородная связь может также возникнуть между атомами водорода и отрицательными атомами полярных групп в одной и той же молекуле. Например, в о-нитрофеноле (а) и салициловом альдегиде (б)
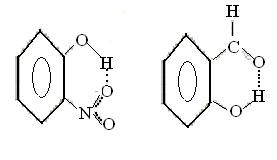
а б
возникает водородная связь между водородом групп –О-Н и кислородом других групп.
Молекулы с внутримолекулярными водородными связями не могут вступать в межмолекулярные водородные связи. Поэтому вещества с такими связями не образуют ассоциатов, более летучи, имеют более низкие вязкости, температуры кипения и плавления, чем их изомеры, способные образовать межмолекулярную связь.
6.2.5 Значение водородных связей Так как многие соединения содержат ковалентные полярные связи Н-О и H-N, то водородные связи очень распространены. Они проявляются не только в воде, но и в различных кристаллических веществах, полимерах, белках, живых организмах. Например, практически все соли образуют кристаллогидраты, в которых имеются водородные связи. Вследствие невысоких значений энергии водородные связи относительно легко разрушаются и вновь возникают.
Важную роль водородные связи играют в белках, у которых спиральные полимерные структуры объединяются связями N-H---O.
Итак, между полярными молекулами, содержащими в одной или обоих молекулах атом водорода, возникают водородные связи, которые существенно влияют на свойства вещества.
Дата добавления: 2015-08-08; просмотров: 1668;
