Вандерваальсовы силы
Взаимодействие между молекулами. Комплексные соединения
В предыдущей главе было рассмотрено взаимодействие атомов с образованием молекул, а также представлены структуры и некоторые свойства молекул. Настоящая глава посвящена взаимодействию молекул.
При сближении молекул появляется притяжение, что обусловливает возникновение конденсированного состояния вещества. К основным видам взаимодействия молекул следует отнести вандерваальсовы силы, водородные связи и донорно-акцепторное взаимодействие.
Вандерваальсовы силы
В 1873 г. голландский ученый И. Ван-дер-Ваальс предположил, что существуют силы, обусловливающие притяжение между молекулами. Эти силы позднее получили название вандерваальсовых сил. Они включают в себя три составляющие: диполь-дипольное, индукционное и дисперсионное взаимодействия.
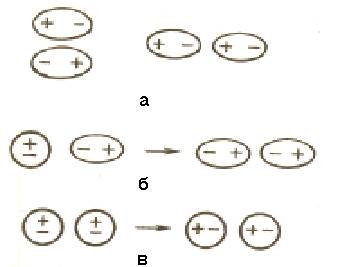
а – диполь-дипольное взаимодействие; б - индукционное взаимодействие;
в – дисперсионное взаимодействие
Рисунок 6.1 – Вандерваальсовы взаимодействия молекул
6.1.1 Диполь-дипольное взаимодействие.При сближении полярных молекул они ориентируются таким образом, чтобы положительная сторона одного диполя была ориентирована к отрицательной стороне другого диполя (рисунок 6.1, а).
Возникающее между диполями взаимодействие называется диполь-дипольным или ориентационным. Энергия диполь-дипольного взаимодействия пропорциональна электрическому моменту диполя в четвертой степени и обратно пропорциональна расстоянию между центрами диполей в шестой степени и абсолютной температуре в первой степени.
6.1.2 Индукционное взаимодействие.Диполи могут воздействовать на неполярные молекулы, превращая их в индуцированные (наведенные) диполи (рисунок 6.1, б). Между постоянными и наведенными диполями возникает притяжение, энергия которого пропорциональна электрическому моменту диполя во второй степени и обратно пропорциональна расстоянию между центрами молекул в шестой степени. Энергия индукционного взаимодействия возрастает с увеличением поляризуемости молекул, т.е. способности молекулы к образованию диполя под воздействием электрического поля. Величину поляризуемости выражают в единицах объема. Поляризуемость в однотипных молекулах растет с увеличением размера молекул (таблища 6.1). Энергия индукционного взаимодействия значительно меньше энергии диполь-дипольного взаимодействия.
6.1.3 Дисперсионное притяжение.В любой молекуле возникают флуктуации электрической плотности, в результате чего появляются мгновенные диполи, которые в свою очередь индуцируют мгновенные диполи у соседних молекул (рисунок 6.1, в). Движение мгновенных диполей становится согласованным, их появление и распад происходит синхронно. В результате взаимодействия мгновенных диполей энергия системы понижается. Энергия дисперсионного взаимодействия пропорциональна поляризуемости молекул и обратно пропорциональна расстоянию между центрами частиц. Для неполярных молекул дисперсное взаимодействие является единственной составляющей вандерваальсовых сил (таблица 6.1).
Таблица 6.1 - Вклад отдельных составляющих в энергию молекулярного взаимодействия
| Вещество | Электри- ческий момент диполя, D | Поляризу- Емость, м3*1030 | Энергия взаимодействия, кДж/моль | Темпера- тура кипения, К | |||
| Ориентации- онная | Индукции- онная | Десперси- онная | суммарная | ||||
| H2 Ar Xe HCl HBr Hl NH3 | 1,03 0,78 0,38 1,52 | 0,8 1,64 4,16 2,64 3,62 5,42 2,23 | 3,3 1,1 0,6 13,3 | 1,0 0,70 0,3 1,5 | 0,17 8,5 18,4 16,8 28,5 60,6 14,7 | 0,17 8,5 18,4 21,1 30,3 61,5 29,5 | 20,2 239,6 |
6.1.4 Энергия вандерваальсова взаимодействия.Энергия всех видов вандерваальсова взаимодействия обратно пропорциональна расстоянию между центрами молекул в шестой степени.
При сильном сближении молекул проявляются силы отталкивания между ними, которые обратно пропорциональны расстоянию между молекулами в двенадцатой степени. Поэтому зависимость результирующей энергии вандерваальсова взаимодействия EB от расстояния между молекулами, IB, выражается уравнением
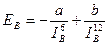 , (6.1)
, (6.1)
где а и b — постоянные.
Минимальная энергия системы обеспечивается при расстояниях между центрами молекул 0,4÷0,5 нм, т.е. существенно больше длины химической связи.
Как видно из таблицы 6.1, с увеличением размера молекул в ряду Аг—Хе и НС1—HI растет их поляризуемость и энергия дисперсионного притяжения. Ориентационное взаимодействие вносит значительный вклад в вандерваальсовы силы лишь в случае молекул с большим электрическим моментом диполя. С увеличением суммарной энергии межмолекулярного взаимодействия возрастет температура кипения жидкостей, а также теплота их испарения. Суммарная энергия вандерваальсового взаимодействия молекул на 1—2 порядка ниже энергии химических связей.
Итак, между молекулами возникают относительно слабые вандерваальсовы взаимодействия, включающие дисперсионные силы, а для полярных молекул и диполь-дипольное притяжение и индукционные взаимодействия.
Дата добавления: 2015-08-08; просмотров: 1864;
