Водородная связь. Водородная связь – особый тип межмолекулярного взаимодействия
Водородная связь – особый тип межмолекулярного взаимодействия. Атомы водорода, которые ковалентно связаны с атомом элемента, имеющего высокое значение электроотрицательности (чаще всего F, O, N, а также Cl, S и C), несут на себе относительно высокий эффективный заряд. Вследствие этого такие атомы водорода могут электростатически взаимодействовать с атомами указанных элементов. Так, атом Нd+ одной молекулы воды ориентируется и соответственно взамодействует (что показано тремя точками) с атомом Оd- другой молекулы воды:
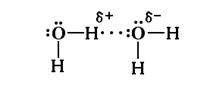
В твердой воде (лед) каждый атом О тетраэдрически окружен четырьмя атомами Н (два их них связаны ковалентно, два других – электростатически); получается соответствующая кристаллическая решетка льда. В жидкой воде практически отсутствуют свободные молекулы Н2О, которые за счет электростатического взаимодействия указанного типа объединяются в агрегаты.
Связи, образуемые атомом Н, находящимся между двумя атомами электроотрицательных элементов, называются водородными:
d- d+ d-
А - Н ××× В
Энергия водородной связи значительно меньше энергии обычной ковалентной связи (150 – 400 кДж/моль). Для соединений фтора она достигает порядка 40 кДж/моль. Однако этой энергии достаточно, чтобы вызвать ассоциацию молекул соответствующих соединений в жидком состоянии, например, в жидком фтороводороде НF (рис. 26).
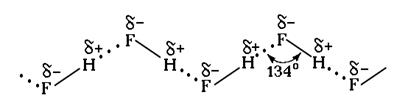
Рис. 26. Агрегация молекул НF за счет водородных связей
Длина водородной связи также меньше длины ковалентной связи. Так в полимере (HF)n длина связи F - H = 0,092 нм, а связи F∙∙∙H = 0,14 нм. У воды длина связи O - H = 0,096 нм, а связи O ∙∙∙ H = 0,177нм.
Образование межмолекулярных водородных связей приводит к существенному изменению свойств веществ: повышению вязкости, диэлектрической постоянной, температур кипения и плавления.
Дата добавления: 2015-07-14; просмотров: 833;
