Поляризация связи и дипольный момент
Электронная плотность в молекулах распределяется в зависимости от электроотрицательности (ЭО) атомов, образующих молекулу. Симметричное расположение зоны повышенной электронной плотности можно объяснить тем, что одинаковые атомы в молекуле, обладающие одной и той же электроотрицательностью, в равной степени действуют на электронную плотность и она располагается симметрично относительно ядер двух атомов. Атомы, имеющие разные значения электроотрицательности, различно влияют на электронную плотность, и при этом она смещается из симметричного положения ближе к тому атому, у которого ЭО больше.
Смещение электронной плотности к атому с большей ЭО получило название поляризации.
Молекулы, образованные атомами, имеющими одинаковую ЭО, являются электросимметричными, т.е. у них “центры тяжестей” положительных и отрицательных зарядов совпадают. Такие молекулы получили название ковалентных неполярных (например, H2, Cl2),а связь вних называется ковалентной неполярной связью.
Молекулы, в которых имеет место поляризация, характеризуются электрической асимметрией, у таких молекул “центры тяжести” положительных и отрицательных зарядов не совпадают.
По этой причине распределение электронной плотности вдоль связи асимметрично, а следовательно, атом более электроотрицательного элемента приобретает отрицательный эффективный заряд (обозначение 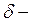 ), а атом-партнер –положительный эффективный заряд (обозначение
), а атом-партнер –положительный эффективный заряд (обозначение 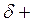 ).
).
Ковалентные связи между атомами, несущими некоторый эффективный заряд, называются полярными ковалентными связями, а молекулы - ковалентно-полярными.
Пример. В молекуле HCl распределение электронной плотности вдоль связи H – Cl таково, что электрический “центр тяжести” отрицательного заряда смещен к атому Cl, а “центр тяжести” положительного заряда – к атому Н. В результате на атомах хлора и водорода возникают эффективные заряды Н  - Cl
- Cl 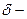 .
.
Полярные молекулыявляются диполями, т.е. системами, состоящими из двух равных по величине и противоположных по знаку зарядов, находящихся на некотором расстоянии один от другого. Полярной является молекула воды Н2О.
Расстояние между центрами положительного и отрицательного зарядов называется длиной диполя 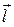 . Полярность молекулы характерзуется величиной ее дипольного момента
. Полярность молекулы характерзуется величиной ее дипольного момента  , который равен векторной сумме дипольных моментов связей, имеющихся в молекуле. Дипольный момент связи равен произведение длины диполя
, который равен векторной сумме дипольных моментов связей, имеющихся в молекуле. Дипольный момент связи равен произведение длины диполя 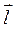 на величину электрического заряда
на величину электрического заряда 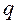 :
:
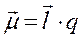 .
. 
Длина диполя имеет значение порядка диаметра атома, т.е. 10-8 см, а величина заряда электрона 1,6 • 10-19 Кл. Дипольный момент выражают в дебаях и обозначают буквой D. В системе единиц СИ дипольный момент измеряется в кулон - метрах (Кл∙м):
1D = 3,3∙10-30 Кл·м.
Например, в ряду галогеноводородов с уменьшением разности ЭО атомов, образующих молекулу, дипольный момент убывает:
  
| ||
| HCl | HBr | HI |
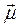 = 1,04 = 1,04
| 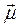 =0,79 =0,79
| 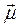 =0,39 =0,39
|
Дипольный момент двухатомных молекул равен дипольному моменту связи. Если связь неполярная, то и молекула неполярна.
В многоатомных молекулах дипольный момент молекулы равен векторной сумме дипольных моментов отдельных связей. Например, молекула СО2 (Оd- = Сd+ = Оd-) - неполярна, хотя связи С = О полярны, так как О ← С → О и суммарный дипольный момент молекулы равен нулю.
Молекула SO2 полярна, дипольный момент 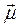 = 1,61 D.
= 1,61 D.
Полярность молекулы зависит не только от наличия в ней полярных связей, но и от геометрической формы молекулы. В рассмотренных примерах молекула СО2 имеет линейное строение, а молекула SO2 – угловое строение.
Дата добавления: 2015-07-14; просмотров: 2086;
