Металлическая связь
Металлы характеризуются рядом особых свойств: электро- и теплопроводностью, характерным металлическим блеском, ковкостью, высокой пластичностью, большой прочностью. Эти специфические свойства металлов можно объяснить особым типом химической связи, получившей название металлической.
У большинства металлов на внешнем электронном уровне имеется значительное число вакантных орбиталей и малое число электронов. Поэтому энергетически более выгодно, чтобы электроны не были локализованы, а принадлежали всему атому металлу. В узлах решетки металла находятся положительно заряженные ионы, которые погружены в электронный “газ”, распределенный по всему металлу:
Me ↔ Men+ + n 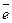 .
.
Между положительно заряженными ионами металла и нелокализованными электронами существует электростатическое взаимодействие, обеспечивающее устойчивость вещества. Энергия этого взаимодействия является промежуточной между энергиями ковалентных и молекулярных кристаллов. Поэтому элементы с чисто металлической связью (s – и p – металлы) характеризуются относительно высокими температурами плавления и твердостью.
Наличие электронов, которые свободно могут перемещаться по объему кристалла, и обеспечивает специфические свойства металлов.
Металлическая связь – результат перекрывания делокализованных орбиталей атомов, сближающихся между собой в кристаллической решетке металла.
Дата добавления: 2015-07-14; просмотров: 782;
