Примеры решения типовых задач. Пример 1. По положению в периодической системе: а) рассмотрите строение электронных оболочек атома кремния; б) составьте электронную формулу и графическую
Пример 1. По положению в периодической системе: а) рассмотрите строение электронных оболочек атома кремния; б) составьте электронную формулу и графическую схему заполнения электронами валентных орбиталей атома в нормальном и возбужденном состояниях.
Решение:
а) Кремний Si имеет порядковый номер 14 и находится в третьем периоде главной подгруппы IV A - группы периодической системы. Следовательно, в атоме кремния 14 электронов, которые расположены на 3-х энергетических уровнях. На внешнем валентном уровне находятся 4 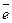 (3s2 3p2), т.е. кремний относится к р-электронному семейству;
(3s2 3p2), т.е. кремний относится к р-электронному семейству;
б) Электронная формула атома кремния: 14Si 1s2 2s2 2p6 3s2 3p2.
Валентными орбиталями в этом атоме являются орбитали внешнего (третьего) электронного уровня, т.е. 3s - и Зр - орбитали и не заполненные Зd-орбитали. Графическая схема заполнения электронами этих орбиталей в нормальном состоянии имеет следующий вид (в соответствии с правилом Гунда):
| ↑↓ | ↑ | ↑ | ||
| ↑↓ | ↑↓ | ↑↓ | ↑↓ | |
| ↑↓ | p | |||
| s |
При затрате некоторой энергии один из Зs -электронов атома кремния может быть переведен на Зр – орбиталь, при этом атом переходит в возбужденное состояние, которому соответствует электронная конфигурация: 1s2 2s2 2p6 3s13p3
| ↑ | ↑ | ↑ | ↑ | |
| ↑↓ | ↑↓ | ↑↓ | ↑↓ | |
| ↑↓ | p | |||
| s |
Максимальная валентность определяется максимальным числом
неспаренных электронов, которые могут быть на валентных орбиталях,
т.е. для атома Si равна 4. Формула оксида - SiO2.
Кремний проявляет неметаллические свойства, образуя кремневую кислоту H2SiO3.
Пример 2. Объясните, на каком основании селен 34Se и молибден 42Мо находятся в одной группе, но в разных подгруппах периодической системы? Какие химические свойства проявляют эти элементы?
Решение: Атомы Se и Мо имеют следующиеэлектронные конфигурации:
Se - 1s2 2s2 2р6 3s2 Зр6 4s2 3d10 4р4;
Mo - 1s22s2 2р6 3s2 Зр6 4s2 3d10 5s1 4d5.
Валентные электроны: Se - 4s2 4p4; Mo - 5s14d5. Таким образом, эти элементы не являются электронными аналогами и не должны размещаться в одной и той же подгруппе одной группы, но в бразовании связей у них может участвовать одинаковое максимальное число электронов - 6 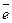 . У селена - это 4s2 4p4, у молибдена - 5s14d5, где 4d5 - электроны предпоследнего (n-1) недостроенного энергетического уровня. На этом основании оба элемента помещены в одну VI группу периодической системы, но в разные подгруппы (Se - VI А , Мо – VI В).
. У селена - это 4s2 4p4, у молибдена - 5s14d5, где 4d5 - электроны предпоследнего (n-1) недостроенного энергетического уровня. На этом основании оба элемента помещены в одну VI группу периодической системы, но в разные подгруппы (Se - VI А , Мо – VI В).
Внешний энергетический уровень атома селена содержит 6 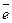 , что определяет его неметаллические свойства. Молибден - металл, так как у него на внешнем энергетическом уровне 2
, что определяет его неметаллические свойства. Молибден - металл, так как у него на внешнем энергетическом уровне 2 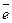 , но если в образовании связей участвуют 4d -электроны, то Мо может проявлять и неметаллические свойства.
, но если в образовании связей участвуют 4d -электроны, то Мо может проявлять и неметаллические свойства.
Формулы высших оксидов: SеO3; МоО3.
Пример 3. Составьте схемы распределения электронов по энергетическим ячейкам в атоме СIи ионе CI-.
Решение. Электронная формула хлора CI0: 1s2 2s2 2p6 3s2 Зр5 3d0. При переходе в ионное состояние происходят следующие изменения конфигурации валентного уровня:
Сl0  Сl- ... 3s2 3p6 3d0
Сl- ... 3s2 3p6 3d0
Тогда схемы распределения электронов по энергетическим ячейкам будут выглядеть следующим образом:
| ↑↓ | ↑↓ | ↑↓ | ↑ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | |||||
| ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | |||||
| ↑↓ | p | ↑↓ | p | |||||||||
| s | s |
Сl0 Сl-
Пример 4. Определите тип химической связи в молекулах NaBr, HBr, Br2.
Решение: Тип химической связи в молекуле можно определить, сравнивая значения электроотрицательности (ЭО) атомов, входящих в ее состав (табл. 5). Молекулы, образованные атомами, имеющими одинаковую электротрицательность (как в данном случае Br2), являются электросимметричными, химическая связь в них– ковалентная неполярная.
Если электроотрицательности атомов отличаются друг от друга (как в данном случае, в молекуле NaBr - ЭОNa ═0,9, ЭОBr ═2,8; в молекуле HBr - ЭОH ═2,1, ЭОBr ═2,8), то связь в молекуле – ковалентная полярная. Чем значительнее отличаются друг от друга значения электроотрицательности атомов, тем более полярной является эта связь.
С увеличением разности между ЭО атомов растет степень ионности связи в молекуле. Разность ЭО, равная 1,7, соответствует 50% -ному ионному характеру связей, поэтому связи с разностью больше 1,7 могут считаться ионными. В молекуле NaBr – разность ЭО равна 1,9; следовательно, химическая связь в ней – ионная. В молекуле HBr разность ЭО равна 0,7 и соответственно, связь в ней – ковалентная полярная.
Пример 5. Определите тип гибридизации и валентные углы в молекуле BeCl2.
Решение: В молекуле ВеСl2 обе химические связи равноценны, несмотря на то что в их образовании участвуют различные орбитали (s и p) центрального атома (электронная формула атома Be в возбужденном состоянии 1s22s12p1). Это объясняется гибридизацией s - и p-орбиталей, приводящей к образованию двух гибридных sp-орбиталей. Относительно друг друга две гибридные sp- орбитали расположены под углом 180 о, поэтому молекулы с таким видом гибридизации линейны.
Таким образом, перекрывание sp – гибридных орбиталей атома бериллия с 3p – АО 2 атомов хлора приводит к образованию линейной молекулы гидрида бериллия ВеСl2; валентный угол Cl –Be - Cl в молекуле ВеСl2 равен 180 о.
Дата добавления: 2015-07-14; просмотров: 2282;
