NADPH-оксидаза – строение, биологические функции.
Фокальные комплексы. В локализации NADPH-оксидаз, участвующих в процессе направленного движения клеток, важную роль играют взаимодействия отдельных субъединиц NADPH-оксидазного комплекса (например, p47phox, Rac1) с каркасными белками или с белками-адаптерами структурных белковых комплексов.
Миграция эндотелиальных клеток (ЭК) играет ключевую роль в процессе
восстановления тканей при повреждениях, ангиогенезе и заживлении ран. В ЭК белок Rac1 и NADPH-оксидазы участвуют в процессе миграции клеток. Сигнальный путь PI-3K → Rac активирует NADPH-оксидазы и способствует продукции АФК в мембранных раффлах (волнообразных выпячиваний цитоплазмы). В настоящее время различают подгруппу эндосом, «сигнальных эндосом», содержащих два представителя семейства NADPH-оксидаз, ферменты Nox1 и Nox2. Значение сигнальной эндосомы в том, что продукция АФК не ограничена цитоплазматической стороной ПМ, а может распространяться к внутриклеточным регионам в зависимости от локализации эндосомы. АФК, продуцируемые NADPH-оксидазами в мембране эндосом, важны для иммунного ответа при воспалениях. Активный комплекс NADPH-оксидазы формируется на мембране эндоплазматического ретикулума.
К настоящему времени в клетках млекопитающих обружены семь изоформ NADPH - оксидаз:NOX1, NOX2, NOX3, NOX4, NOX5, DUOX1 и DUOX2. Все NADPH - оксидазы представляют собой трансмембранные белки, которые переносят электроны через клеточные мембраны, восстанавливая при этом молекулярный кислород до супероксид&анион&радикала или пероксида водорода. Каталитические субъединицы всех NADPH - оксидаз обладают шестью трансмембранными доменами и содержат два гема. NADPH - оксидазы найдены только в эукариотических клетках, хотя у прокариот известны схожие по строению и функции белки. Наиболее хорошо изучена основная изоформа NADPH - оксидаз фагоцитов – NOX2. Она экспрессируется в нейтрофилах и моноцитах, а также, в меньших количествах, практически во всех других типах клеток. Основу NOX2 составляют две мембранные субъединицы: p91phox и p22phox, где аббревиатура phoxотражает фагоцитарную природу оксидазы (phagocyte oxidase). Три цитоплазматические субъединицы (p47phox, p67phox, p40phox) и малый G-белок Rac1 присоединяются к ним при формировании холоферментного комплекса. Основная каталитическая субъединица комплекса, p91phox, состоит из шести трансмембранных доменов; она содержит участок связывания NADPH и простетическую группу FAD в C-концевой, цитоплазматической части. Ее центральная часть содержит два гемма между третьим и пятым трансмембранными доменами.
От цитоплазматического NADPH электрон переносится на FAD и далее через два гема на кислород. Вторая мембранная субъединица, p22phox, содержит два трансмембранных домена, она постоянно ассоциирована с каталитической p91phox. Во время сборки NADPH&оксидазы она привлекает цитоплазматические субъединицы, специфически связывая p47phox [22, 23].
В неактивном состоянии цитоплазматические компоненты фагоцитарной NADPH&оксидазы (p47phox, p67phox и p40phox) образуют комплекс. Белок p47phox выступает в качестве организатора комплекса, а p67phox – в качестве активатора. Чтобы p47phox могла связаться с мембранными субъединицами, она должна быть фосфорилирована протеинкиназой С.
NOX1 экспрессируется во многих типах клеток, в том числе в клетках гладкой мускулатуры кровеносных сосудов, эндотелии, в остеокластах, нейронах и глиальных клетках, в эпителии кишечника, а также в фибробластах. NOX1 регулирует рост и миграцию гладкомышечных клеток. Вдобавок, NOX1 участвует в регуляции кровяного давления. NOX3 обнаружена только в эмбриональных тканях, причем почти исключительно в тканях внутреннего уха. NOX4 экспрессируется в клетках многих тканей, в том числе гладкомышечных, эндотелиальных клетках, остеокластах, нейронах и в фибробластах. Особенно много NOX4 в клетках почечных канальцев. В клетке эта изоформа NADPH&оксидазы располагается главным образом на цитоплазматической стороне мембраны эндоплазматического ретикулума, а также в ядре. Активная NOX4 представляет собой димер Nox4 и р22phox.
NOX5 экспрессируется в эмбриональных тканях и матке. Во взрослом организме NOX5 обнаружен в T- и B-лимфоцитах, кишечнике и селезенке. В дополнение к доменам, гомологичным p91phox, в ее N&конце находятся Ca2+-связывающие последовательности “EF&руки”. Считается, что активация синтеза происходит при связывании ионов Ca2+и не зависит от
цитоплазматических белков-активаторов.
NADPH&оксидазы группы DUOX (DUOX1 и DUOX2) по структуре представляют собой дальнейшее “усовершенствование” NOX5. Они активируются ионами Са2+, а образуемые ими вне клетки АФК сразу используются для модификаций соединительной ткани. Помимо участков,
гомологичных p91phox, и “EF&руки”, эти изоформы содержат внеклеточный пероксидазный домен. Его аминокислотная последовательность очень близка к последовательности миелопероксидазы пероксисом – фермента, катализирующего взаимодействие Cl–и Н2О2 с образованием гипохлорной кислоты. Однако окисление ферментами DUOX1/2 хлоридионов не показано.
Поскольку именно пероксидазный домен DUOX1/2 вовлечен в АФК-зависимую модификацию внеклеточного матрикса, скорее всего
эту функцию выполняет Н2О2.
6. Восстановленный глутатион – структура, биосинтез, антиоксидантные эффекты. Рециклизация GSSG, роль глутатионредуктазы.
Глутатион-глутаредоксиновая система (GSH&R) во многом дублирует функции тиоредоксиновой системы. Глутатион (GSH) представляет собой трипептид γ&глутамилцистеинилглицин, содержащий остаток цистеина. Глутатион окисляется до дисульфида глутатиона (GSSG), восстанавливая при этом окисленный субстрат. GSН регенерируется конститутивно активными
глутатионредуктазами, содержащими в активном центре FAD. Концентрация глутатиона в эукариотических клетках очень высока (например, в клетках печени она превышает 5 мМ), при этом практически весь глутатион находится в восстановленной форме. Высокая концентрация и разнообразие антиоксидантных систем, находящихся во всех компартментах клеток, и их строгая регуляция обеспечивают жесткий контроль уровня Н2О2в цитоплазме, определяя локальное и кратковременное функционирование этой молекулы в качестве вторичного посредника.
Глутатион - у-глутамилцистеинилглицин, представляет собой неправильный трипептид, включенный в одну из систем обмена - систему глутатиона. В организме глутатион представлен двумя основными формами - восстановленной (ВГ), имеющий следующее структурное строение
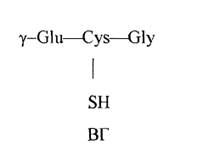
Биологическое значение системы глутатиона многообразно и затрагивает практически все стороны жизнедеятельности клеток:
1) конъюгация ксенобиотиков и их метаболитов; 2) защита от повреждающего действия АФК и реакционно-способных метаболитов ксенобиотика; 3)поддержание тиол-дисульфидного равновесия; 4) поддержание восстановленной среды клетки; 5) регулирующее влияние на углеводный, липидный и белковый обмены путем взаимодействия восстановленной и окисленной формы глутатиона при физиологических концентрациях с рядом белков и ферментов; 6) поддержание гемоглобина эритроцитов в восстановленном состоянии, восстановление метгемоглобина и защита эритроцитов от гемолиза; 7) транспорт аминокислот через клеточную мембрану; 8) поддержание оптимального состояния и функций биологических мембран; 9) участие в синтезе нуклеиновых кислот и белков; 10) регуляция процессов клеточной пролиферации и опухолевого роста; 11) участие в механизмах старения клетки; 12) участие в обмене ряда эйкозаноидов-простагландиновилей-котриенов; 13) резерв цистеина в клетке; 14) участие в регуляции функциональной активности лимфоцитов и обеспечении иммунного ответа организма; 15) регуляция синтеза белков теплового шока, обеспечивающих защиту клетки от денатурированных белков и,возможно,вызывающихихренатурацию; 16) участие в механизмах адаптации к гипоксии; 17) препятствие реализации механизмов клеточной гибели (некроз и апоптоз); 18) участие в реализации механизмов глутаматной эксайто токсичности ишемического повреждения тканей головного мозга.
Последние современные исследования только расширяют представления о биологических функциях системы глутатиона.
Синтезпроисходитв 2 этапа: поддействиему-глутамилцистеин-синтетазы и глутатионсинтетазы.Первый фермент является ключевым, регуляция его активности (и синтеза ВГ в целом) осуществляется по принципу обратной связи путем ингибирования восстановленным глутатионом.
Распад глутатиона на первом этапе катализируется у-глутамилтрансферазой (ГГТФ), которая является ключевым ферментом данного процесса. Дальнейшее превращение глутатиона до аминокислот происходит под
действиему-глутамилциклотрансферазы, 5-оксопролиназыидипептидаз.
Распад глутатиона тесно связан с трансмембранным переносом аминокислот, так как в его результатео бразуется у-глутамил-производное аминокислоты и дипептид-цистеинилглицин. Кроме того, ГГТФ принимает участие во втором этапе глутатионовои конъюгации, под ее воздействием от комплекса глутатион-субстрат происходит отщепление остатка глутаминовой кислоты. Регуляция активности ГГТФ(искоростираспадаВГ) в тканях происходит при участии цАМФ-зависимогопротеинкиназного механизма. Так, рост содержания цАМФ в тканях вызывает снижение активности ГГТФ и повышение внутриклеточной концентрации ВГ.
Глутатионредуктаза - флавопротеин, состоящий из двух идентичных субъединиц, содержащих флавинадениндинуклеотид, молекулярная масса фермента около10 5кДа(эритроцитычеловека). ГР является классическим цитозольным ферментом, активность которого регулируется цАМФ-зависимым механизмом. Каталитическая активность ГР также зависит от состояния ее SH-rpynn, поэтому при физиологических концентрациях ВГ оказывает ингибирующее влияние на фермент. ГР катализирует следующую реакцию:
2НАДФН+ОГ- >2НАДФ" ^+2ВГ.
Скорость НАДФН-зависимого восстановления окисленного глутатиона в ВГ под действием глутатион-редуктазы(ГР) намного превосходит возможности его синтеза de novo в тканях. Необходимым условием для осуществления глутатион редуктазнои реакции является наличие в тканях достаточного уровня НАДФН,так как его расходование приэ том в 6раз выше, чем на биосинтез жирных кислот и обеспечение процессов микросомального окисления. Основным источником восстановленной формы НАДФ является ключевая реакция пентозофосфатного пути метаболизма углеводов – глюкозо-6-фосфатдегидрогеназная(Г-6-Ф-ДГ), которая и лимитирует возможности редокс-циклирования глутатиона.
7. Семейство тиоредоксинов, строение, внутриклеточная локализация, антиоксидантные эффекты. Тиоредоксинредуктаза.
Тиоредоксины(Trx) – семейство белков, которые осуществляют восстановление дисульфидных связей в других окисленных белках, например пероксиредоксинах, путем так называемого дисульфидного обмена. При этом в белке-субстрате дисульфидная связь восстанавливается, а в Trx, наоборот, замыкается. Trx-редуктазы восстанавливают пул окисленного Trx при участии NADH.
Изоформы тиоредоксина Trx1 и Trx2 способны восстанавливать внутри- и межмолекулярные дисульфидные связи в белках, в частности, в окисленных пероксиредоксинах, разлагающих органические гидроперекиси, Н2О2, пероксинитрит. НАДФН-зависимая тиоредоксинредуктаза, восстанавливающая целый ряд субстратов, в т.ч. окисленную форму тиоредоксина, также может напрямую восстанавливать гидроперекиси липидов, Н2О2, дегидроаскорбиновую и липоевую кислоты. Глутаредоксин, основными изоформами которого у человека и млекопитающих являются Grx1, Grx2, Grx5, как и тиоредоксин, катализирует S-глутатионилирование белков, защищая SH-группы от окисления и
деглутатионилирование, восстанавливая функционально активные тиолы.
Основой редокс-сигнализации является то, что окисляющие условия поддерживаются стабилизирующими дисульфидами на внешней поверхности клетки, в то время как внутренняя среда поддерживается в восстановленном состоянии с помощью свободных сульфгидрильных групп.
Итак, главная дисульфидредуктаза — тиоредоксин, ответственная за поддержание внутри клетки восстановленного состояния, представляет собой низкомолекулярный редокс-активный белок с двумя цистеиновыми остатками в активном центре. Тиоредоксин присутствует во всех клетках животных, включая клетки сердца.
Имеются указания на то, что тиоредоксин может быть индуцирован при окислительном стрессе и играть важную роль в регулировании передачи сигналов активными формами кислорода при ишемии-реперфузии. Он может быть важным компонентом защиты клеток от ишемического повреждения мышцы сердца. Тиоредоксин ослаблял повреждение мышиных эндотелиальных клеток после гипоксии-реоксигенации в среде без тиолов, что свидетельствовало о защитном действии тиоредоксина при ишемическом повреждении миокарда с помощью механизма редокс-сигнализации.
Активация МАР-киназ под действием активных форм кислорода(АФК) начинается с активации редокси-зависимой киназы ASK-1 (Apoptosis Signal Regulating Kinase-1). Активность ASK-1 зависит от тиоредоксина — низкомолекулярного многофункционального тиолсодержащего белкового фактора. В зависимости от состояния SH-группы, тиоредоксин находится либо в окисленном, либо в восстановленном состоянии.
Среди этих белков выделяются две тиолдисульфидредуктазы – тиоредоксин (Trx) и глутаредоксин (Grx), которые входят в состав суперсемейства тиоредоксинов. Эти ферменты полифункциональны и образуют тио- редоксин- и глутаредоксин-зависимые системы, играющие важную роль в поддержании внутриклеточного редокс-гомеостаза. Первая система содержит помимо тиоредоксина НАДФН-зависимую тиоредоксинредуктазу (TrxR), которая восстанавливает окисленную форму тиоредоксин. Вторая система включает глутатион (GSH) в качестве агента, восстанавливающего окисленный глутаредоксин, и глутатион- редуктазу, восстанавливающую глутатион из его окисленной формы (GSSG).
Следует также отметить антиоксидантную активность тиоредоксинредуктазы 1 (TrxR1), которая обладает способностью напрямую восстанавливать многие субстраты, в том числе гидроперекиси липидов, Н2 О2 , дегидроаскорбиновую и липоевую кислоты.
Тиоредоксин (КФ 1.8.4.8) – полифункциональный низкомолекулярный белок, имеющий в своей структуре активный дитиол/дисульфидный участок и обладающий оксидоредуктазной активностью. Впервые обнаруженный вЕ. coli Trx позднее найден вомногих эукариотических и прокариотических клетках.
Trx1 человека – низкомолекулярный белок (12 кДа), состоящий из 105 а. о. и локализованный в основном в цитоплазме, обнаружен также в клеточном ядре и плазме крови. Trx2 синтезируется вначале в виде белка-предшественника (18 кДа), содержащего 166 аминокислот, включая N-концевую последовательность из 60 аминокислот, которая после удаления в ходе посттрансляционного протеолиза превращается в Trx2 (12,2 кДа) и экспортируется в митохондрии. Белок р32TrxL имеет высокую степень гомологии с Trx1 и также локализован в цитоплазме, однако его функция не вполне ясна. Установлено, что Trx1 может претерпевать посттрансляционную модификацию: в результате частичного протеолиза он превращается в Trx80, состоящий из 80 N-концевых а. о. Этот фермент секретируется из клетки и обладает цитокин-подобной активностью. S-нитрозилирование по Cys69 важно для антиапоптотического действия Trx1, а его глутатионилирование по Cys73 может предотвращать димеризацию Trx1, вызываемую окислительным стрессом. Trx1 и TrxR1 могут находиться как внутри клеток, так и во внеклеточном пространстве. Различные типы клеток, включая опухолевые, секретируют Trx1, причем, по-видимому, секреция не чувствительна к окислению. Однако процесс секреции может изменяться в присутствии различных ксенобиотиков, включая алкилирующие агенты. Сравнительное изучение секреции на нормальных клетках печени и клетках HepG2 гепатокарциномы показало, что только нормальные клетки обладают высокой секрецией Trx1, секреция же Trx1 клетками HepG2 усиливалась в присутствии 80 мкМ 2-меркаптоэтанола или 5 мМ N-ацетилцистеина. Однако позже эти клетки претерпевали морфологические изменения, сопровождающиеся ингибированием их роста. Экзогенный Trx1 (100 нМ) ингибировал пролиферацию клеток HepG2, но не индуцировал секрецию эндогенного Trx1.
Обе изоформы тиоредоксина вносят заметный вклад в антиоксидантную защиту клеток, что определяется не только их способностью восстанавливать каталитическую активность пероксиредоксинов и глутатионпероксидаз, разлагающих гидроперекиси и H2 O2, но и способностью Trx1 непосредственно восстанавливать H2 O2 и GSSG. Кроме того, обе изоформы могут играть роль «ловушки» • OH радикалов. Известно, что Trx1 служит кофактором рядаферментов, таких, например, как пероксиредоксины, рибонуклеотидредуктазы и метионинсульфоксидредуктазы, участвует в репарации ДНК.
TrxR (КФ1.8.1.9, систематическое название «тиоредоксин:НАДФH-оксидоредуктаза») является НАДФН-зависимым гомодимером оксидоредуктазы (с одним ФАД на субъединицу), которая восстанавливает активный центр дисульфида в окисленном Trx. Молекулярная масса субъединицы TrxR млекопитающих составляет 55–65 кДа, у прокариот, растений и дрожжей – 35 кДа. Выявлены и охарактеризованы три изоформы TrxR млекопитающих: цитоплазматическая (TrxR1), митохондриальная (TrxR2) и TrxR, катализирующая восстановление как Trx, так и GSSG и называемая тиоредоксинглутатионредуктазой (TGR), высокое содержание которой обнаружено в семенниках. Все три изоформы обладают одинаковой структурой домена и характеризуются наличием селеноцистеина (Sec) в С-концевом активном центре (Gly–Cys–Sec– Gly–COOH). В то же время у цитозольной мРНК TrxR1 обнаружены три 5'-нетранслируемые области и наличие альтернативного ATG кодона в структуре гена, значение которых пока не ясно. Изоформа TGR отличается наличием дополнительного N-концевого монотиольного домена.
Механизм катализа TrxR. Вначале осуществляется перенос электрона с НАДФН через ФAД на дисульфид в активном центре, образованном остатками Cys в положении 59 и 64 в N-концевом домене, который идентичен аналогичному домену в глутатионредуктазе. Затем электроны переносятся от образовавшегося дитиола одной субъединицы в димерном ферменте на селенилсульфид в С-концевой последо- вательности другой субъединицы. Такой перенос электронов на другую субъединицу может иметь место и при восстановлении GSSG глутатионредуктазой. Восстановленный С-концевой Sec участвует в восстановлении многочисленных субстратов TrxR1 у млекопитающих.
Дата добавления: 2015-08-11; просмотров: 6360;
