Активные формы кислорода – классификация, свойства, функции.
В случае классического рецепторного сигналинга в ответ на взаимодействие лиганда с рецептором в клетке продуцируется диффундирующий вторичный мессенджер, который передает сигнал путем взаимодействия со своей мишенью. Подобный механизм одновременно способствует и распространению сигнала в пространстве за счет быстрой диффузии мессенджера, и амплификации сигнала, так как многие вторичные мессенджеры продуцируются ферментативным путем в большом количестве в ответ на стимул. Как правило, вторичные мессенджеры – это маленькие диффундирующие молекулы, которые способны быстро активировать белки-эффекторы (например, протеинкиназы, фосфатазы, ионные каналы) путем связывания с ними или их химической модификации.
Наиболее хорошо изученными вторичными мессенджерами являются циклические нуклеотиды (cAMP, cGMP), разнообразные липиды (инозитфосфаты, эйкозаноиды) и ионы (Са2+, Zn2+).
Исторически сложилось мнение, что активные формы кислорода (АФК) являются побочными продуктами окислительного метаболизма и не имеют специфической функции. Однако открытие участия АФК в регуляции многих сигнальных путей позволило предполагать, что их внутриклеточная продукция – это ответ клеток на окружающие стимулы.
Основным свойством вторичного мессенджера является специфичность по отношению к эффектору, участвующему в сигнальном пути. Специфичность действия АФК может достигаться как за счет кинетики реакций, осуществляемых ими, так и за счет пространственных отношений между мессенджером и мишенью.
Супероксидный анион-радикал (далее супероксид) O2–окисляет тиолы до тиил-радикала, который далее может инициировать радикальную цепную реакцию. Однакоконстанта скорости этой реакции относительно небольшая (~ 103 M-1 с-1, pH 7.4). В действительности, окисление тиолов супероксидом скорее представляет собой реакцию с гидроперекисным радикалом НO2•(протонированной формой O2–, pKa для О2 – 4.7), чем с самим O2–. При рН 7.0 константа скорости реакции окисления тиолов супероксидом становится незначительной по сравнению с константами скорости ферментативных реакций для цитоплазматических и митохондриальных супероксиддисмутаз (более 109 M-1 с-1).
Супероксид, продуцируемый различными изоформами NADPH-оксидазы (Nox1, Nox2 и др.), имеет возможность принять участие в сигналинге, однако внутри клетки супероксид под действием супероксиддисмутаз мгновенно дисмутирует в Н2О2. Таким образом, наиболее вероятная сигнальная роль супероксида in vivo –это быть предшественником Н2О2.
Существует группа белков, претендующих на роль внутриклеточных сенсоров супероксида, а именно некоторые Fe2S2-содержащие белки, в которых один из ионов железа, составляющих кластер, обращен в водную фазу (Fe2S2-белки). Такой ион может легко подвергаться окислению супероксидом, что вызывает разрушение кластера Fe2S2*и, как следствие, изменение конформации белка. Наиболее изученными «рецепторами» супероксида подобного рода являются белки SoxR из Escherichia coli и аконитазы. В условиях окислительного стресса Fe2S2*-содержащий белок SoxR в цитоплазме E.coli подвергается окислению супероксидом, в результате чего кластерное соединение теряет целостность. Белок, изменив
конформацию, запускает транскрипцию ряда генов, в том числе гена супероксиддисмутазы.
Подобным образом окисляется и железо кластера Fe4S4* аконитаз (другое название цитоплазматической аконитазы – IRP1, iron regulatory protein). IRP1 с разрушенным кластером приобретает способность связываться с РНК, содержащей участок IRE (iron responsive element), и подавлять трансляцию ряда белков, в число которых ферритины, митохондриальная аконитаза и транскрипционный фактор HIF-2α.
По сути, механизм супероксидопосредованного переключения функций белков, в составе которых обнаружены кластерные соединения типа Fe2S2*, может оказаться универсальным путем передачи сигналов, связанных с энергетическими функциями клетки, поскольку многие белки-хелаторы ионов металлов переменной валентности задействованы в
транспорте электронов от окисляемых субстратов к конечным акцепторам.
Гидроксил-радикал OH•крайне реакционноспособен и не обладает специфичностью в реакциях практически ни с одной из органических молекул. Гидроксил-радикал образуется в качестве вторичного продукта свободнорадикальных реакций с участием супероксида и пероксида водорода. Поэтому эта молекула не рассматривается в качестве мессенджера.
Синглетный кислород (O2) продуцируется в клетках неферментативным путем, поэтому пока нет никаких данных о времени и месте его специфической продукции – характерных критериев вторичного мессенджера. Кроме того, до сих пор не обнаружено ни одного физиологического процесса окисления с участием синглетного кислорода, что также делает маловероятным его рассмотрение в качестве сигнальной молекулы.
Пероксид водорода – единственный из АФК, благодаря контролируемым
ферментативным процессам своей продукции и деградации, обеспечивающим специфичность времени и места присутствия H2O2, претендует на звание вторичного мессенджера. Важным свойством вторичного мессенджера является его способность контролировать активность ферментов, вовлеченных в передачу сигнала внутри клетки. H2O2 способна регулировать активность сигнальных белков через их окислительную модификацию, используя в качестве мишеней сульфгидрильные группы белковых молекул.
2. Пероксид водорода – основная сигнальная молекула, характеристика.
Продукция пероксида водорода. Около 80% перекиси водорода, появляющегося в очаге воспаления, образуется в клетке в результате реакции дисмутации супероксида (уравнение 1), генерируемого NADPH-оксидазами (Nox).
2O2– + 2H+ - H2O2+ O2(1)
Использование цитотоксичной молекулы H2O2 в качестве сигнала представляет собой очевидный риск для клетки, поэтому не удивительно, что продукция Н2О2 NADPH-оксидазами в высокой степени регулируется. Активация NADPH-оксидаз осуществляется через контролируемую многостадийную сборку активного комплекса на мембране. Процесс сборки
запускается в ответ на стимуляцию клеток, например, факторами роста и цитокинами. Пероксид водорода, продуцируемый внеклеточно, может проникать в клетку и также вносить вклад в редокс-сигналинг.
Топология его продукции. NADPH-оксидазы переносят электроны из цитоплазмы в компартменты, топологически эквивалентные внеклеточному пространству (просвет эндосом, люмен эндоплазматического ретикулума) и собственно во внеклеточную среду. Там и образуется супероксид – предшественник Н2О2.
Так, группой Джона Энгельгардта показано, что супероксид транспортируется в цитоплазму через анионные каналы. С другой стороны, реакция дисмутации достаточно эффективна и в отсутствие супероксиддисмутаз, причем скорость реакции возрастает при снижении рН. Поэтому для поздних эндосом, в которых рН смещен в сторону кислых значений, можно ожидать образования Н2О2 в люмене с последующей
диффузией в цитоплазму. И хотя Н2О2 может свободно диффундировать через мембраны in vitro, в клетке изменения в составе липидов и белков мембран, а также присутствие каналов для Н2О2 (например, аквапоринов) могут регулировать проницаемость мембран для Н2О2 и возможность его взаимодействия со специфичными белками-мишенями.
Механизм передачи сигнала с помощью Н2О2. Основным механизмом, благодаря которому Н2О2 может выполнять сигнальную функцию, является специфичная, обратимая модификация некоторых аминокислотных остатков в белках. В основном к таким остаткам относятся цистеины, однако и другие аминокислоты могут подвергаться окислению Н2О2. Пероксид водорода действует как сигнальная молекула путем прямого взаимодействия с аминокислотными остатками белка-мишени или опосредованно, с привлечением пероксидаз. В одних случаях продукты таких реакций ингибируют функцию белка, блокируя важные каталитические аминокислотные остатки, например, цистеины в активных центрах
тирозинфосфатаз. В других –модификации в белке-мишени могут привести к изменению его конформации или изменениям во взаимодействии с другими белками и таким образом способствовать активации или ингибированию функции модифицируемого белка или связанных с ним белков.
Одним из наиболее важных факторов, влияющих на возможность белка
взаимодействовать с Н2О2 и, в результате, принимать участие в редокс-сигналинге, является скорость реакции окисления белка Н2О2. Так как Н2О2 взаимодействует с SH-группами остатков цистеина, то их конформационная доступность и степень депротонирования являются лимитирующими факторами, определяющими их реакционную способность. Благодаря этим
двум факторам действие Н2О2 является специфичным, что и наблюдается в процессе редокс-сигналинга. Доступность аминокислотного остатка зависит от структуры белка. Белки, участвующие в редокс-сигналинге, содержат тиолы, которые доступны для тех сигналов, которые они должны «чувствовать». Степень ионизация тиола (уравнение 2), зависит от величины рН и присутствия вблизи цистеиновых остатков положительно заряженных
аминокислотных остатков, которые стабилизируют отрицательно заряженный тиол и таким образом снижают значение его рKа.
PrSH ⇄ PrS–+ H+ Pr –белок (от protein) (2)
Для обычных тиольных групп белков среднее значение рKа (8.0 – 8.5) выше величины значения рН биологических систем, что исключает взаимодействие этих групп с Н2О2 в физиологических концентрациях. Большинство белков-сенсоров Н2О2 имеют остаток цистеина с низким значением рKа. Дополнительной особенностью, благодаря которой может быть увеличена скорость реакции Н2О2 с тиолом белка, является присутствие аминокислотных остатков, стабилизирующих переходное состояние окисляемого остатка. Подобное аминокислотное окружение, обспечивающее более высокую скорость реакции с Н2О2, встречается в активных центрах ферментов-антиоксидантов, например, у тиоловых пероксидаз, которые предназначены для деградации Н2О2. Другие редокс-чувствительные белки,
участвующие в сигналинге, например,бактериальный транскрипционный фактор OxyR, могут также иметь такие аминокислотные остатки, стабилизирующие переходное состояние.
Реакция Н2О2 с тиольными группами белков приводит к образованию
цистеинсульфеновой кислоты (уравнение 3).
PrS–+ H2O2 - PrSOH + HO– (3)
Сульфенаты белков OxyR и Orp1 неустойчивы и часто превращаются в другие производные. Сульфенаты могут быть в дальнейшем окислены Н2О2 до более высокой степени окисления: сульфиновой и сульфоновой кислоты (уравнения 4 и 5).
PrSOH+ H2O2 - PrSO2H+ H2O (4)
PrSO2H + H2O2 - PrSO3H + H2O(5)
В отличие от сульфеновой кислоты, сульфиновая и сульфоновая кислоты более стабильны, чем сульфеновая, и с трудом поддаются восстановлению in vivo. Образование сульфиновой кислоты играет важную роль в процессе редокс-регуляции пероксиредоксинов и, возможно, других белков, где эта модификация приводит к ингибированию функций белка, если затрагивает ключевой каталитический остаток Cys. Сульфиновая кислота в пероксиредоксинах далее может быть медленно восстановлена обратно в сульфеновую кислоту с помощью семейства белков сестринов и сульфиредоксинов при участии ATP.
С другой стороны, образование сульфоновой кислоты считается необратимой реакцией, так как до сих пор не известны системы, восстанавливающие ее in vivo. Помимо превращения в соединения с более высокими степенями окисления, сульфенаты могут также реагировать с низкомолекулярными тиолами с образованием смешанных дисульфидов (уравнение 6); с другими остатками Cys с образованием межцепочечных дисульфидных связей (уравнение 7), а также взаимодействовать с амидными группами боковой
цепи белка с образованием циклических сульфаниламидов (уравнение 8).
PrSOH + RS– - PrS-SR + HO– (6)
PrSOH + PrS– - PrS-SPr + HO– (7)
Pr –белок (от protein)
R –углеводородный радикал.
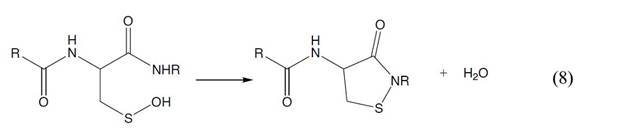
Если присутствует конформационно доступная тиольная группа, предпочтительным, как правило, является формирование внутрицепочечной дисульфидной связи, т.к. локальная концентрация атакующего тиола в таком случае является высокой. В других случаях первоначально образованный сульфенат может образовать смешанный дисульфид с тиоловыми кофакторами (глутатион, коэнзим А, тиоредоксин). Ввиду высокого содержания глутатиона у большинства клеток, образование смешанного дисульфида с глутатионом – наиболее часто наблюдаемая модификация, которая может регулировать активность многих белков.
Кроме прямого механизма модификации остатков полипептидной цепи белка с образованием цистеинсульфенатов, Н2О2 может также играть роль редокс-сигнала через окисление глутатиона и тиоредоксина – универсальных переносчиков восстановительных эквивалентов в клетке, поддерживающих «дисульфидный» гомеостаз. Глутатион и тиоредоксин имеют высокие внутриклеточные концентрации и поддерживаются в восстановленном
состоянии с помощью NADPH-зависимых редуктаз. Реакция дисульфидного обмена (уравнение 9) может в равной степени происходить, например, с глутатионом с образованием глутатионилированого белка или с образованием глутатиондисульфида.
PrS-SPr + RS– - PrS-SR +PrS–
R –углеводородный радикал (9)
Дисульфид глутатиона и смешанные дисульфиды, образованные таким образом, могут взаимодействовать с тиолом белка через реакцию тиол-дисульфидного обмена. Реакция тиол-дисульфидного обмена между глутатиондисульфидом и SH-группой белка in vivo проходит достаточно медленно, однако эта реакция может катализироваться глутаредоксином.
В процессе редокс-сигналинга важными условиями модификаций белков,
индуцированных пероксидом водорода, является их обратимость, а также контроль над процессом обратного восстановления сульфената или сульфината до тиола. Все вышеописанные модификации, кроме образования сульфоновой кислоты, являются обратимыми in vivo, поскольку существуют системы, контролирующие восстановление продуктов. В большинстве случаев такие модификации обратимы благодар реакции тиол-дисульфидного обмена с участием восстановленной формы глутатиона или тиоредоксина. Таким образом, редокс-статус пар Trx(SH)2/TrxSS и GSH/GSSG является важным фактором, влияющим на модификации. Восстановление сульфинатов белков опосредовано сестринами и сульфиридоксином. Процесс является АТP-зависимым и, следовательно, связанным с энергетическим статусом клетки. Итак, Н2О2 может модифицировать белки несколькими способами и таким путем изменять их функции. Вид, степень и продолжительность модификации тиольных групп белков зависит от значения их рКа и от их доступности, а также от энергетического и редокс-статуса клетки, в особенности от редокс-пар Trx(SH)2/TrxSSи GSH/GSSG.
КОМПАРТМЕНТАЛИЗАЦИЯ СИГНАЛА ЗА СЧЕТ КИНЕТИЧЕСКИХ И
ДИФФУЗИОННЫХ ОГРАНИЧЕНИЙ.
При физиологических значениях pH и достижимой внутри клеток концентрации H2O2 константа скорости реакции окисления остатков цистеина в активном центре фосфатазы PTP-1B в концентрации 0.1 мкM составляет 20 M–1с–1, для фосфатазы Cdc25B(cell cycle–activating phosphatase 25B) с тем же значением концентрации – в несколько раз больше –160 M–1с–1. Для GSH в концентрации 2 мM эта величина составляет 0.89 M–1 с–1. Все представители семейства передоксинов (Prx1 – Prx6) характеризуются исключительно высокой скоростью реакции с Н2О2. Для Prx2 эта константа равна 2 × 107 M–1 с–1, и, поскольку Prx2находится в
клетке в избытке (~20 мкМ), то способен вступать в реакцию практически со всем произведенным в ней Н2О2. GSH конкурирует лишь за незначительную часть Н2О2, а SH-группы остатков цистеинов протеинтирозинфосфатаз не конкурентоспособны даже для GSH. Таким образом, только низкое значение pKa тиольных групп остатков цистеина не обеспечивает их высокую реакционную способность. Даже учитывая то, что РТР и другие
белки с существенными остатками Cys являются мишенями Н2О2 в ходе сигналинга, они не конкурентоспособны для белков-антиоксидантов с точки зрения кинетики. Подобный анализ кинетики реакций предполагает, что все они осуществляются в гомогенном растворе, с неограниченной диффузией субстратов и ферментов. Однако существует механизм, который позволяет менее реакционноспособным субстратам взаимодействовать с Н2О2
в присутствии более конкурентоспособных участников. Такой механизм основан на высокой степени неоднородности реакционной смеси (в данном случае –цитоплазмы клетки). Если Н2О2 может сначала полностью окислить высоко реакционноспособную мишень в ограниченной области клетки, то далее он способен прореагировать здесь же с менее реакционноспособным субстратом, например с фосфатазой. Этот принцип является основой гипотезы «шлюза» («floodgate»). Согласно этой гипотезе, при высокой концентрации Н2О2происходит переокисление цистеина в активном центре Prx с образованием сульфиновой кислоты (уравнение 4), и, как следствие, его инактивация. Благодаря этому Н2О2 получает возможность далее взаимодействовать с другими своими белками-мишенями. Реакция восстановления Prx после переокисления – энергетически зависима и
катализируется ферментом сульфиредоксином. В основу гипотезы «шлюза» положено предположение о том, что низкие концентрации Н2О2 эффективно нейтрализуются Prx, а высокие концентрации Н2О2 приводят к локальной инактивации пероксиредоксинов, что способствует далее окислению сигнальных белков-мишеней.
Согласно этой гипотезе, диффузионное расстояние, т.е. расстояние, которое окислитель преодолевает до взаимодействия с мишенью, должно быть относительно небольшим по сравнению с диаметром клетки (в среднем 10–20 мкм). Восстановленный глутатион в концентрации, соответствующей внутриклеточной, не способен ограничить диффузию Н2О2 в пределах диаметра клетки. Присутствие же большого количества высоко реакционноспособных пероксиредоксинов является достаточным условием для ограничения диффузии Н2О2 в пределах нескольких микрон. Поэтому для эффективного окисления белка-мишени необходимо его прямое взаимодействие с комплексом, продуцирующим Н2О2. Возможностью повысить вероятность прохождения реакции между Н2О2 и его мишенью является локализация белка-мишени и источника Н2О2(Nox) в пределах одного клеточного компартмента.
Дата добавления: 2015-08-11; просмотров: 34393;
