Семейство пероксиредоксинов – строение, внутриклеточная локализация, антиоксидантные функции.
Пероксиредоксины (далее Prx) – это семейство белков, катализирующих восстановление Н2О2 и алкилгидропероксидов до воды и спирта. Для этого процесса пероксиредоксины используют восстанавливающие эквиваленты, предоставляемые тиоредоксином, тиоредоксинредуктазой (TR) и NADPH(уравнение 11):
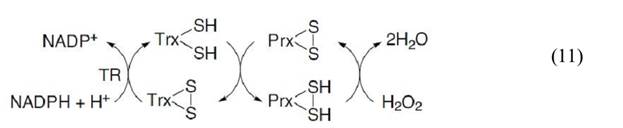
По строению активного центра выделяют три группы пероксиредоксинов: типичные 2Cys-Prx, атипичные 2Cys-Prx и 1Cys-Prx. Выделяемые таким образом группы различаются количеством и консервативностью расположения цистеиновых остатков. У млекопитающих, как и у большинства эукариот, представители типичных 2Cys-Prx взаимодействуют с Н2О2 с образованием сульфеновой кислоты, которая затем быстро преобразуется в внутрицепочечный дисульфид. Иногда в присутствии Н2О2 сульфеновая кислота взаимодействует со второй молекулой Н2О2 и окисляется до сульфиновой кислоты, что таким образом инактивирует фермент. Участие пероксиредоксинов в регуляции концентрации Н2О2 позволяет предположить, что переокисление может служить важным механизмом, благодаря которому в некоторых случаях Н2О2 имеет возможность избежать деградации и принять участие в сигнальных каскадах. В дальнейшем, рол этого механизма в редокс-сигналинге была подтверждена благодаря открытию сульфиредоксинов и сестринов, способных восстанавливать сульфиновую кислоту пероксиредоксинов до тиола. Кроме того, экспрессия генов этих белков
регулируется в ответ на окислительный стресс.
Пероксиредоксины локализуются почти во всехкомпартментах эукариотических клеток. Как и каталазы, эти пероксидазы представляют собой важный компонент антиоксидантной системы. Физиологический диапазон концентраций пероксида водорода, с которыми способны справиться пероксиредоксины составляет 1-10 мкM. Превышение этих концентраций вызывает переокисление и инактивацию пероксиредоксинов, что может иметь и защитную функцию. Дело в том, что восстановление пероксиредоксинов требует постоянного расхода NADPH. При окислительном стрессе пероксиредоксины становятся основным субстратом для тиоредоксина, быстро истощая пул NADPH. Переокисленный пероксиредоксин перестает быть субстратом тиоредоксина. Клетка перестает тратить NADPH на борьбу с оксидантом, сохраняя ценный субстрат для восстановления других белков, так в борьбе с пероксидом водорода подключается каталаза, имеющая высокое сродство к пероксиду и использующая одну молекулу Н2О2 для восстановления другой.
10. Роль АФК в регуляции NF-kB-зависимых сигнальных путей.
Наиболее полно изучен процесс активации NF-kB, который вклю- чает 3 этапа: 1) фосфорилирование ингибиторной IkB субъединицы, 2) ее диссоциацию из неактивного комплекса и 3) деградацию IkB субъединицы. У отдельных типов клеток АФК могут активировать NF-kB, тогда как антиоксиданты препятствуют этой активации. Кроме того, индукторы NF-kB, такие, например, как TNF-α, стимулируют повышение уровня образования АФК. Для транслокации NF-kB через ядерную мембрану и связывания с ДНК необходимо восстановление критических остатков Cys. Поэтому клеточный редокс-статус явля- ется ключевым для контроля состояния активации NF-kB.
Развитие клеточного цикла и апоптоз – связанные между собой процессы и нарушение регуляции активности Cdc2-киназы в клетках млекопитающих может приводить к запуску процесса апоптоза. Известно, что одним из цитокинов, индуцирующих образование АФК в ходе передачи внутриклеточного сигнала, является TNFα, который индуцирует апоптоз посредством связывания с death-доменом рецептора TNFα. В этом процессе TNFα активирует транскрипционный фактор NF-kB, участвующий в редокс-зависимой регуляции генов. Установлено, что сверхэкспрессия гена PRDX2 ингибирует активацию NF-кВ после стимуляции клеток Н2 О2, а сверхэкспрессия этого гена в клетках лейкемии Molt-4 оказывает защитное действие против апоптоза, вызываемого церамидом или этопозидом.
Другим транскрипционным фактором, активирующимся в условиях окислительного стресса, является NF-kB. Данный протеин играет существенную роль в регуляции иммунного ответа, воспалительной реакции, а также в контроле клеточного деления и апоптоза.
Доминирующую роль АФК в индукции данного транскрипционного фактора при дисбалансе окислительного метаболизма. Возможно, активирующие сигналы при остром воспалении (TNF-α, бактериальные липополисахариды), наряду с АФК, приводят к высвобождению NF-kB из комплекса с ингибитором. Однако показано, что р65 субъединица вызывает индукцию генетической транскрипции IkB частицы, которая может связаться с NF-kB и вернуть его в неактивное состояние. Подобная негативная регуляция функции NF-kB может объяснять одинаковый уровень данного транскрипционного фактора в клетках при экспериментальном окислительном стрессе и остром воспалении.
Дата добавления: 2015-08-11; просмотров: 1706;
