Характеристики химической связи.
К важнейшим характеристикам связи относятся: длина, полярность, дипольный момент, насыщаемость, направленность, прочность, кратность связи.
Длиной связи – называется расстояние между ядрами атомов в молекуле. Длина связи определяется размерами ядер и степенью перекрывания электронных облаков.
Длина связи в HF равна 0,92∙10-10, в HCl – 1,28∙10-10м. Химическая связь тем прочнее, чем меньше ее длина.
Углом связи (Валентным углом) называют угол между воображаемыми линиями, проходящими через ядра химически связанных атомов. ∟HOH=1040,5; ∟H2S=92,20; ∟H2Sе=910,0.
Важнейшей характеристикой химической связи является энергия, определяющая ее прочность.
Количественно прочность связи характеризуют энергией, затрачиваемой на ее разрыв, и измеряется в кДж, отнесенных к 1 моль вещества.
Поэтому количественно прочность связи характеризует энергия сублимации Есубл. вещества и энергия диссоциации молекулы на атомы Едисс.. Под энергией сублимации понимается энергия, затрачиваемая для перехода вещества из твердого состояния в газообразное. Для двухатомных молекул энергия связи равна энергии диссоциации молекулы на два атома.
Например, Едисс.(а следовательно Есв.) в молекуле H2 составляет 435кДж/моль. В молекуле F2=159 кДж/моль, в молекуле N2=940 кДж/моль.
Для не двухатомных, а многоатомных молекул типа АВn средняя энергия связи
ЕАВ= 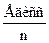
 (1),
(1),
в силу АВn=А+nВ.
Например, энергия, поглощаемая в процессе
H2O=2H+O
равна 924 кДж/моль.
Энергия связи
ЕOH= 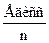 =
= 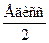 =
= 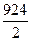 = 462 кДж/моль.
= 462 кДж/моль.
Заключение о структуре молекул и строении вещества делают по результатам полученных разными методами. При этом используют полученную информацию не только о длинах и энергиях связи, валентных углах, но и других свойствах вещества, таких, например, как магнитные, оптические, электрические, тепловые и другие.
Совокупность экспериментально полученных данных о строении вещества дополняют и обобщают результаты квантово-химических расчетных методов, которые используют концепцию квантово-механической теории химической связи. Считается, что химическая связь в основном осуществляется валентными электронами. У s- и p- элементов валентными являются электроны орбиталей внешнего слоя, а у d-элементов – электроны s-орбитали внешнего слоя и d-орбитали предвнешнего слоя.
Дата добавления: 2015-08-08; просмотров: 1467;
