Лекция 4. Классификация и номенклатура неорганических соединений
Простые вещества и химические соединения. Оксиды: основные, кислотные и амфотерные. Номенклатура оксидов. Зависимость кислотно-основного характера оксидов от положения в периодической системе и степени окисления элемента. Химическое взаимодействие между оксидами с образованием солей. Гидроксиды основные и амфотерные, кислоты. Их номенклатура и получение. Соли: нормальные, кислые и основные. Номенклатура солей. Получение и свойства солей.
Номенклатура и свойства комплексных соединений.
Неорганические соединения различают по составу (бинарные и многоэлементные) и функциональным признакам. К бинарным соединениям относят соединения элементов с кислородом (оксиды), галогенами (галогениды – фториды, хлориды, бромиды, иодиды), халькогенами (халькогениды – сульфиды, селениды, теллуриды), азотом (нитриды), фосфором (фосфиды), углеродом (карбиды), кремнием (силициды), а также соединения металлов друг с другом (интерметаллиды) и водородом (гидриды). Среди многоэлементных соединений выделяют гидроксиды (вещества, содержащие гидроксидные группы - ОН), производные гидроксидов – соли, а также комплексные соединения, гидраты и кристаллогидраты.
В соответствии с правилами ИЮПАК наименование любого вещества должно однозначно указывать на его состав. Поэтому в основу систематических .е. нование любого вещества должно однозначно указывать на его состав, поэтому в основу системаи соединений, нные соотношения названий неорганических веществ положены названия элементов, входящих в их состав.
Название бинарного соединения образуется из латинского корня наименования более электроотрицательного элемента с окончанием –ид и русского наименования менее электроотрицательного элемента в родительном падеже. При написании формулы вещества менее электроотрицательный элемент стоит левее. Например, Al2O3 – оксид алюминия, AgI – иодид серебра, OF2 – фторид кислорода. Для некоторых элементов корни их русских названий совпадают с корнями латинских, за исключением элементов, представленных ниже в таблице 1:
Таблица 1
Названия химических элементов
| Символьная запись | Русское название | Латинское название |
| Ag | Серебро | Аргент- |
| As | Мышьяк | Арс-, арсен- |
| Au | Золото | Аур- |
| C | Углерод | Карб-, карбон- |
| Cu | Медь | Купр- |
| Fe | Железо | Ферр- |
| H | Водород | Гидр-, гидроген- |
| N | Азот | Нитр- |
| Ni | Никель | Никкол- |
| O | Кислород | Окс-, оксиген- |
| Pb | Свинец | Плюмб- |
| S | Сера | Сульф-, тио- |
| Sb | Сурьма | Стиб- |
| Si | Кремний | Сил-, силиц-, силик- |
| Hg | Ртуть | Меркур- |
| Mn | Марганец | Манган- |
| Sn | Олово | Станн- |
Для обозначения количественного состава используют греческие числительные в качестве приставки, например, Hg2Cl2 – дихлорид диртути, СО – монооксид углерода, СО2 - диоксид углерода.
Числительные приставки имеют следующие названия:
1 - Моно- 5 - Пента- 9 - Нона-
2 - Ди- 6 - Гекса- 10 - Дека-
3 - Три- 7- Гепта- 11 - Ундека-
4 - Тетра- 8 - Окта- 12- Додека-.
Название многоэлементного соединения отражает его функциональные признаки, такие как принадлежность к гидроксидам или кислотам. Гидрооксиды – это соединения оксидов с водой. Их подразделяют на основные, проявляющие в химических реакциях свойства оснований, кислотные – проявляющие свойства кислот, амфотерные – способные проявлять как кислотные, так и основные свойства.
К классу оснований, согласно теории электролитической диссоциации, относят вещества, способные в водном растворе диссоциировать с образованием гидроксид-ионов ОН-: Наименование основного гидроксида (или основания) образовано из слова «гидроксид» и названия элемента в родительном падеже, после которого при необходимости указывают степень окисления элемента. Например, NaOH – гидроксид натрия, Fe(OH)2 – гидроксид железа (II) или дигидроксид железа. Общую формулу основания можно записать как М(ОН)m , где М – металл, m- число гидроксильных групп, или кислотность основания.
Вещества, способные диссоциировать в растворе с образованием ионов водорода Н+, в соответствии с теорией электролитической диссоциацией относят к классу кислот.
Кислоты в зависимости от наличия в их составе кислорода подразделяются на кислородсодержащие и на безкислородные. В общем случае формулу кислоты можно записать как НnА, где А – кислотный остаток, n – число атомов водорода в молекуле, или основность кислоты.
Систематическое название кислоты включает в себя наименование двух частей: электроположительной (атомы водорода) и электроотрицательной (кислотный остаток, анион). В названии аниона вначале указывают атомы кислорода (-оксо-), затем кислотообразующего элемента с добавлением суффикса -ат, далее в скобках абсолютную величину степени окисления этого элемента. Например, H2CO3 – триоксокарбонат (IY) водорода, Н2SO4 – тетраоксосульфат (VI) водорода. При наличии в анионе других атомов название аниона составляют из латинских корней названий соответствующих элементов и соединительной гласной -о- в порядке их размещения в формуле справа налево. Например, H2SO3 (O2) – пероксотриоксосульфат (VI) водорода, Н2SO3S – тиотриоксосульфат (VI) водорода. Систематические наименования наиболее употребительных кислот представлены в таблице 3.
Традиционное название состоит из двух слов – прилагательного, производного от корня названия кислотообразующего элемента, и слова «кислота», например, Н2SO4 – серная кислота, НNO3 – азотная кислота.
Амфотерные гидрооксиды способны диссоциировать в водных растворах как по типу оснований, так и по типу кислот, например,
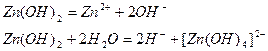
При взаимодействии с кислотами они проявляют свойства оснований, а при взаимодействии с основаниями – свойства кислот. Их названия составляют по схеме, соответствующей основным гидроксидам.
Таблица 2
Названия важнейших кислот и их солей
| Формула кислоты | Названия | |
| Кислоты | Соли | |
| HAlO2 | Метаалюминиевая | Метаалюминат |
| HAsO3 | Метамышьяковая | Метаарсенат |
| H3AsO4 | Ортомышьяковая | Ортоарсенат |
| HAsO2 | Метамышьяковистая | Метаарсенит |
| H3AsO3 | Ортмышьяковистая | Ортоарсенит |
| HBO2 | Метаборная | Метаборат |
| H3BO3 | Ортоборная | Ортоборат |
| H2B4O7 | Четырёхборная | Тетраборат |
| HBr | Бромводород | Бромид |
| HOBr | Бромноватистая | Гипобромит |
| HBrO3 | Бромноватая | Бромат |
| HCOOH | Муравьиная | Формиат |
| CH3COOH | Уксусная | Ацетат |
| HCN | Циановодород | Цианид |
| H2CO3 | Угольная | Карбонат |
| H2C2O4 | Щавелевая | Оксалат |
| HCl | Хлороводород | Хлорид |
| HOCl | Хлорноватистая | Гипохлорит |
| HClO2 | Хлористая | Хлорит |
| HClO3 | Хлорноватая | Хлорат |
| HClO4 | Хлорная | Перхлорат |
| HCrO2 | Метахромистая | Метахромит |
| H2CrO4 | Хромовая | Хромат |
| H2Cr2O7 | Двухромовая | Дихромат |
| HI | Йодоводород | Йодид |
| HOI | Йодноватистая | Гипойодит |
| HIO3 | Йодноватая | Йодат |
| HIO4 | Йодная | Перйодат |
| HMnO4 | Марганцовая | Перманганат |
| H2MnO4 | Марганцовистая | Манганат |
| H2MoO4 | Молибденовая | Молибдат |
| HN3 | Азидоводород (азотистоводородная) | Азид |
| HNO2 | Азотистая | Нитрит |
| HNO3 | Азотная | Нитрат |
| HPO3 | Метафосфорная | Метафосфат |
| H3PO4 | Ортофосфорная | Ортофосфат |
| H4P2O7 | Двуфосфорная (пирофосфорная) | Дифосфат (пирофосфат) |
| H3PO3 | Фосфористая | Фосфит |
| H3PO2 | Фоснофорноватистая | Гипофосфит |
| H2S | Сероводород | Сульфид |
| HSCN | Родановодород | Роданид |
| H2SO3 | Сернистая | Сульфит |
| H2SO4 | Серная | Сульфат |
| H2S2O3 | Тиосерная | Тиосульфат |
| H2S2O7 | Двусерная (пиросерная) | Дисульфат (пиросульфат) |
| H2S2O8 | Пероксодвусерная (надсерная) | Пероксидосульфат (персульфат) |
| H2Se | Селеноводород | Селенид |
| H2SeO3 | Селенистая | Селенит |
| H2SeO4 | Селеновая | Селенат |
| H2SiO3 | Кремниевая | Силикат |
| HVO3 | Ванадиевая | Ванадат |
| H2WO4 | Вольфрамовая | Вольфрамат |
Соли представляют собой продукты замещения ионов водорода кислоты на металл или гидроксильных групп основания на кислотный остаток. В зависимости от полноты замещения атомов водорода или гидроксильных групп соли подразделяют на средние (или нормальные), например К2SO4, кислые (или гидросоли) например NaHCO3, и основные (или гидроксосоли) например FeOHCl. Различают также двойные соли, образованные двумя металлами и одним кислотным остатком (КАl(SO4)2), и смешанные соли, образованные одним металлом и двумя кислотными остатками (СаСlОСl). Названия солей обусловлены систематическими названиями соответствующих кислот, например, К2SO4 – тетраоксосульфат (VI) калия, NaHCO3 – триоксокарбонат (IY) водорода-натрия, FeOHCl или, точнее, FeClOH – гидрокси-хлорид железа (II).
При наличии числовых приставок (1, 2, . . . ) в названии вещества для верного понимания формулы применяют умножение приставки (например, КАl3(SO4)2(OH)6 – гексагидроксид-бис(сульфат) триалюминия-калия). Названия приставок следующие:
1 Монокис- 5 Пентакис- 9 Нонакис-
2 Бис- 6 Гексакис- 10 Декакис-
3 Трис- 7 Гептакис- 11 Ундекасис-
4 Тетракис- 8 Октасис- 12 Додекакис-
Традиционные наименования солей также содержат названия анионов в именительном падеже и названия катионов в родительном падеже (см. табл. 2), например, К2SO4 – сульфат калия, NaHCO3 – гидрокарбонат натрия, FeOHCl – гидроксохлорид железа (II).
Оксиды в зависимости от характерных функций, выполняемых в химических реакциях, подразделяют на солеобразующие (среди них выделяют основные, кислотные и амфотерные) и несолеобразующие.
Основные оксиды образуют соли при взаимодействии с кислотами или кислотными оксидами. Им соответствуют основания, так как они их образуют при взаимодействии с водой, например СаО – Са(ОН)2.
Кислотные оксиды образуют соли при взаимодействии с основаниями или основными оксидами. Они могут быть получены путем отделения воды от соответствующей кислоты. Поэтому их называют также ангидридами кислот, например SO3 – ангидрид Н2SO4.
Амфотерные оксиды образуют соли как при взаимодействии с кислотами, так и при взаимодействии с основаниями, например, ZnO, Al2O3 .
Гидраты и кристаллогидраты – соединения, содержащие в своем составе воду, например, NH3 ∙ Н2О ∙ Fe2O3, nH2O, СuSO4 ∙ 5Н2О. Как систематические, так и традиционные названия таких соединений начинаются со слова «гидрат» с соответствующей приставкой: NH3 ∙ Н2О – гидрат аммиака, Fe2O3 ∙ nH2O – полигидрат оксида железа (III), СuSO4 ∙ 5Н2О – пентагидрад тетраоксосульфата меди (II), или пентагидрад сульфата меди (II).
Лекция 5. Химическая термодинамика
Химическая термодинамика. Термодинамические системы. Термодинамические параметры. Термодинамический процесс. Внутренняя энергия, теплота, работа. Первый закон термодинамики. Энтальпия. Закон Гесса и следствия из него. Энтропия. Второе начало термодинамики. Свободная энергия Гиббса и свободная энергия Гельгмольца.
Химическая термодинамика.
Термодинамика изучает взаимное превращение теплоты, работы и различных видов энергии. Слово термодинамика происходит от греческих слов термос (тепло) и динамос (сила, мощь). Термин термодинамика был введён Томсоном в 1854 году, который употребил его как синоним понятий теплота и работа.
Термодинамика основывается на трёх фундаментальных принципах, которые называются началами термодинамики. Они являются обобщением многочисленных экспериментальных фактов.
Применение методов термодинамики к химическим реакциям и процессам обусловили появление химической термодинамики. Предметом изучения химической термодинамики является превращение энергии при химических взаимодействиях, которые происходят при протекании химических процессов.
Термодинамические системы. Термодинамические параметры. Термодинамический процесс.
Термодинамика использует ряд понятий и модельных представлений, таких как термодинамическая система, параметры состояния, энергия, теплота, работа. Перейдем к их рассмотрению.
Понятие система означает ту часть материального мира, которую мы исследуем. Например, химический стакан с водой, реактор на химическом предприятии. Остальная часть материального мира, за пределами условно выделенной системы – называется окружением.
Термодинамической системой – называется совокупность тел, которая фактически или мысленно может быть выделена из окружающей среды. Система отделена от окружения границей, через которую совершается материальный обмен - массообмен или (и) теплообмен. В зависимости от степени изолированности различают открытые, закрытые, изолированные системы.
Открытые системы – это системы, которые обмениваются с внешней средой веществом, механической работой, теплотой и излучением. Например, в пробирке смешивается карбонат натрия (сода) с раствором хлорводородной кислоты. В результате протекает реакция
Na2CO3 + HCl = NaCl + CO2↑ + H2O.
В рассматриваемом химическом процессе масса системы уменьшается, так как улетучивается диоксид углерода, и выделяется тепло, часть которого идёт на нагрев окружающего воздуха.
Закрытые системы – системы, которые не обмениваются с внешней средой веществом, но взаимодействуют с ней посредством механической работы, теплообмена и излучения. Примером закрытой системы является пробирка, в которой происходит смешение соды с хлорводородной кислотой, закрытая пробкой.
Изолированные системы – системы невзаимодействующие с внешней средой. Между изолированной системой и окружением не происходит никакого обмена ни веществом, ни энергией. На практике понятие абсолютно изолированных систем не существует, оно является абстрактным, мысленным построением. Примером приближенно изолированной системы является термос или сосуд Дьюара.
Система может находиться в том или ином состоянии. Состоянием системы называется совокупность физических и химических свойств, характеризующих систему.
Состояние термодинамической системы характеризуют параметры состояния: давление, объём, температура, концентрация.
Давление (Р) характеризует подвижность молекул и определяется силой, с которой газообразные частицы действуют на стенки сосуда. Давление измеряют в Па (Паскаль), атм (атмосфера), мм рт. ст. (миллиметры ртутного столба): 1 атм = 760 мм рт. ст. = 101325 Па.
Объём (V) характеризует часть пространства, занимаемого веществом. Измеряют объём в м3 (кубический метр), см3 (кубический сантиметр), л (литр), мл (миллилитр): 1 м3 = 1000 л; 1л = 1000 мл.
Температура (Т, t) характеризует степень нагретости системы и измеряется в К (шкала Кельвина) и 0С (шкала Цельсия). Для перевода температур, выраженных в разных шкалах, используют выражение
Т = t + 273 (1).
Концентрация вещества (с) определяет количественный состав раствора, смеси, расплава. Например, молярная концентрация – количество молей вещества в 1 л раствора или смеси, обозначается через моль/л.
Таким образом, набор параметров (р, V, Т) называется состоянием системы, так как считается, что он полностью определяет состояние. Термодинамические параметры являются макроскопическими величинами, измеряемыми в опыте. Они являются функциями состояния, то есть их изменение определяется только начальным и конечным состояниями и не зависит от пути процесса, в результате которого произошло это изменение
∆ Т = Ткон – Тнач = Т2 – Т1 (2).
Для бесконечно малых изменений можно записать
∆ Т = dT (3).
Если величина не является функцией состояния, а зависит от пути процесса, то она является функцией перехода. В этом случае бесконечно малое изменение величины А записывают в виде
∆А = δА (4).
Таким образом, знак ∆ - обозначает изменение величины, являющейся функцией состояния, знак δ – обозначает изменение величины, являющейся функцией перехода.
Термодинамические параметры не являются независимыми, а связаны уравнением состояния. Примером такого уравнения является уравнение состояния идеального газа, которое называется уравнением Менделеева-Клайперона
pV = nRT (5),
где n – число молей газа; R – газовая постоянная.
Состояние термодинамической системы может изменяться с течением времени. Обычно такое изменение фиксируется при измерении одного из термодинамических параметров. Поэтому в термодинамике используется понятие термодинамического процесса.
Термодинамическим процессом называется всякое изменение в системе, связанное с изменением хотя бы одного параметра. Таким образом, термодинамический процесс – это изменение состояния системы. Различают следующие процессы: изохорный (V = const), изобарный (p = const), изотермический (T = const), адиабатный (теплота Q = 0).
Термодинамические процессы бывают:
-обратимые, когда переход из одного состояния в другое и обратно может происходить по одному и тому же пути, и после возвращения в исходное состояние в окружающей среде не остаётся макроскопических изменений; примером обратимого процесса является сжатие и растяжение пружины;
-необратимые или неравновесные, когда параметры изменяются с конечной скоростью и переход из одного состояния в другое и обратно не может происходить по одному и тому же пути, в результате в окружающей среде остаются макроскопические изменения; примером необратимого процесса является пластическая деформация металлической проволоки.
Внутренняя энергия, теплота, работа.
Кроме термодинамических параметров немаловажную роль играют и другие термодинамические величины, такие как работа и теплота. Они являются количественной мерой термодинамических процессов и характеризуют участие системы в термодинамических процессах. Работа и теплота являются энергетическими характеристиками. Поэтому рассмотрим понятие энергии.
Энергия происходит от греческого слова «действие» - есть мера способности совершать работу. Энергия измеряется в Дж (Джоуль). Многочисленные наблюдения и опытные факты говорят о следующих свойствах энергии.
Энергия не исчезает и не возникает из ничего.
Энергия может существовать в разнообразных формах.
В изолированной системе энергия может переходить из одной формы в другую, но её количество остаётся постоянным.
Если система не изолирована, то её энергия может изменяться, но при одновременном изменении энергии внешней среды на точно такую же величину.
Любая система обладает определённым запасом энергии, то есть энергия неотъемлемое свойство системы.
Для рассмотрения химических процессов важны следующие формы энергии: солнечная, механическая, химическая, ядерная, электрическая.
Различают следующие виды энергии: кинетическую (энергия движения), потенциальную (энергия положения и взаимодействия) и внутреннюю энергию (энергию состояния).
Дата добавления: 2015-08-08; просмотров: 2158;
