Первый закон термодинамики
Внутренняя энергия системы – это сумма потенциальной энергии взаимодействия всех её частиц между собой и кинетической энергии их движения. Так как химическая система состоит из молекул, атомов, ионов, электронов и все эти частицы обладают энергией, то внутренняя энергия системы включает следующие составляющие: энергию колебательного, вращательного и поступательного движений молекул, ионов, атомов, электронов, энергию межмолекулярного, внутримолекулярного, внутриатомного и внутриядерного взаимодействия.
Таким образом, внутренняя энергия тела – это общий запас энергии тела за вычетом кинетической энергии тела в целом и потенциальной энергии его положения в пространстве.
Абсолютная величина внутренней энергии тела неизвестна, но опыт показывает, что важно знать только изменение внутренней энергии тела.
Внутренняя энергия системы – есть функция состояния. Её изменение определяется лишь начальным и конечным состоянием системы. Внутренняя энергия не зависит от пути процесса, следуя которому система перешла в данное состояние, а однозначно определяется самим состоянием. Обозначают внутреннюю энергию через U, а её изменение через ∆U. Изменение ∆U определяется как разность значений внутренней энергии в состояниях 1 и 2:
∆U = U2 – U1 (6).
Как функция состояния внутренняя энергия может быть выражена через параметры состояния. Для простой системы внутренняя энергия может быть задана в виде функции двух параметров состояния
U = U(T, V) (7);
dU = (dU/dT)dT + (dU/dV)dV (8),
где dU – полный дифференциал внутренней энергии.
В этом отношении внутренняя энергия сходна с температурой, давлением, объёмом, которые также являются функциями состояния.
Поскольку внутренняя энергия зависит от массы, поэтому она является экстенсивной величиной, каковыми являются объём, масса, количество вещества.
Температура, давление и все удельные и молярные характеристики являются интенсивными величинами.
Все изменения внутренней энергии при её переходе от одной системы к другой можно разбить на две группы: передача теплоты и совершение работы.
Теплота
Теплотой называется форма непосредственной передачи энергии молекулами одной системы молекулам другой при их контакте. Переход энергии происходит за счёт хаотического столкновения молекул двух контактирующих систем. Известно, что частицы, находящиеся внутри тела или какой-нибудь выделенной системы, находятся в постоянном тепловом движении. Эта тепловая энергия представляет собой кинетическую энергию поступательного и вращательного движения молекул в системе или внутри тела, а также энергию колебаний атомов в молекуле. Мерой тепловой энергии является температура. Чем выше температура тела, тем большим запасом тепловой энергии оно располагает. При контакте тел с разной температурой запас тепловой энергии будет передаваться от тела с большей температурой телу с меньшей температурой. Мерой энергии, переданной таким способом в форме теплоты, является количество теплоты, которое обозначается через Q или q.
Работа
Работа – это форма перехода энергии, совершаемая при перемещении масс под действием механических сил. Общей мерой энергии, передаваемой таким способом, является величина, обозначаемая через А, которая определяется как произведение величины пути, прошедшего системой под действием силы, на величину этой силы и данная величина носит название работы.
В термодинамике принято следующее правило знаков: работа системы является положительной, если её совершает сама система, количество тепла является положительным, если тепло подводится к системе.
Рассмотрим работу, совершаемую газом при его расширении (на рисунке газ находится в верхней части) или сжатии (на рисунке газ находится в нижней части).
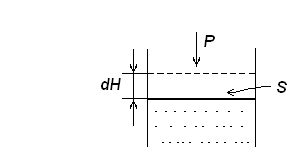
Рис. 1. Поршень, иллюстрирующий совершение работы при расширении
( сжатии) газа.
Из рис. 1 видно, что при давлении газа Р на поршень, площадью S, он совершает перемещение на расстояние dH. Так как при этом действует сила равная p∙S, то при бесконечно малом перемещении, газ совершает элементарную работу равную
δА = p∙S∙ dH = pdV (9).
Работа, совершаемая системой при переходе из состояния 1 в состояние 2, будет определяться следующим выражением
А = 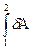 =
= 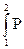 dV (10).
dV (10).
В начальном состоянии 1 объём системы был V1, в конечном состоянии 2 объём системы равен V2. Величина интеграла равна площади под кривой 1-2 (смотри рисунок). Как видно из рисунка величина работы зависит от пути процесса при переходе системы из состояния 1 в состояние 2. Поэтому о работе нельзя говорить, как о свойстве системы, системе нельзя приписать определенный запас работы. Работа является мерой изменения энергии при переходе системы из одного состояния в другое.
Работа и теплота зависят от способа перехода системы из одного состояния в другое, то есть работа и теплота являются функциями перехода и не являются функциями состояния.
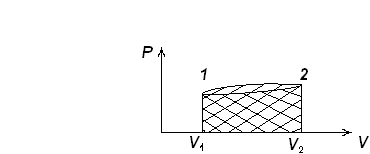
Рис. 2. Определение работы расширения газа: заштрихованная
площадь под кривой 1-2 равна работе, которую совершает газ
при своём расширении.
Дата добавления: 2015-08-08; просмотров: 734;
