Взаимодействие солей с водой, в результате которого образуются кислота (или кислая соль), и основание (или основная соль), называется гидролизом солей.
Правило направления протекания ионных реакций: реакции между ионами в растворах электролитов идут практически до конца в сторону образования осадков, газов и слабых электролитов.
Гидролизу подвергаются соли образованные:
- слабым основанием и сильной кислотой (например, MgCl2, CuSO4), и гидролиз идет по катиону, т.к. молекулы слабого электролита образуются за счет катионов;
- слабой кислотой и сильным основанием (например, Na2CO3, K2S, CH3COONa), и гидролиз идет по аниону, т.к. молекулы слабого электролита образуются за счет анионов;
- слабым основанием и слабой кислотой (например, NH4CN, CH3COONH4), и гидролиз идет по аниону и катиону, т.к. молекулы слабого электролита образуются за счет анионов и катионов.
Соли, образованные сильным основанием и сильной кислотой (например, NaCl, Na2SO4, KNO3) гидролизу не подвергаются, т.к. в этом случае не образуются молекулы слабого электролита.
Уравнения реакций гидролиза пишутся аналогично другим ионным уравнениям: малодиссициированные (в том числе вода) и малорастворимые, а также газообразные продукты гидролиз и исходные вещества пишутся в виде молекул, сильные электролиты записываются в ионной форме. Краткое ионное уравнение показывает какие ионы (Н+ или ОН–) накапливаются в растворе данной соли при растворении, что позволяет определить реакционную среду рассматриваемой соли. Так, если в кратком ионном уравнении имеются ионы Н+, то реакция среды раствора этой соли кислая, а гидролиз будет идти по катиону. Если в кратком ионном уравнении имеются ОН–, то реакция среды раствора этой соли щелочная, а гидролиз будет идти по аниону. Если же краткое ионное уравнение показывает, что в растворе присутствуют и ионы Н+ и ОН–, то реакция среды нейтральная, а гидролиз будет идти и по и аниону и по катиону.
Пример. Составить уравнение гидролиза ацетата натрия СН3СООNа (соль сильного основания и слабой кислоты) и определить реакцию среды в растворе этой соли.
– запишем уравнение реакции гидролиза в молекулярной форме:
СН3СООNа + Н2О 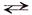 СН3СООН + NаОН
СН3СООН + NаОН
(образовался слабый электролит – уксусная кислота)
– составим полное ионное уравнение данной реакции:
СН3СОО– + Nа+ + Н2О 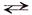 СН3СООН + Nа+ + ОН–
СН3СООН + Nа+ + ОН–
– составим краткое ионное уравнение данной реакции:
СН3СОО– + Н2О 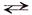 СН3СООН + ОН–
СН3СООН + ОН–
Краткое ионное уравнение гидролиза показывает, что в растворе накапливаются ионы ОН– и реакция среды будет щелочной (рН > 7).
Пример. Составить уравнение гидролиза хлорида железа (II) – соли слабого основания и сильной кислоты, определить реакцию среды в растворе этой соли.
FеСl2 + Н2O 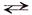 Fе(ОН)Сl + НСl
Fе(ОН)Сl + НСl
Fе2+ + 2Сl– + Н2O 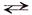 Fе(ОН)– + Сl– + Н+ + Сl–
Fе(ОН)– + Сl– + Н+ + Сl–
Fе2+ + Н2O 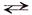 Fе(ОН)– + Н+
Fе(ОН)– + Н+
По второй ступени гидролиз протекает следующим образом:
Fе(ОН)Сl + Н2O 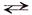 Fе(ОН)2↓ + НСl
Fе(ОН)2↓ + НСl
Fе(ОН)– + Сl– + Н2O 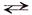 Fе(ОН)2↓ + Н+ + Сl–
Fе(ОН)2↓ + Н+ + Сl–
Fе(ОН)– + Н2O 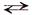 Fе(ОН)2↓ + Н+
Fе(ОН)2↓ + Н+
Краткое ионное уравнение гидролиза показывает, что в растворе накапливаются ионы Н+ и реакция среды будет кислой (рН < 7).
В общем случае:
- если соль образована сильным основанием и слабой кислотой, то рН > 7;
- если соль образована слабым основанием и сильной кислотой, то рН < 7;
- если соль образована слабым основанием и слабой кислотой, то рН ≈ 7;
- если соль образована сильным основанием и сильной кислотой, то рН = 7.
Гидролиз солей, образованных слабым многоосновным основанием или слабой многоосновной кислотой, протекает ступенчато, число ступеней гидролиза равно заряду катиона слабой кислоты или слабого основания (если гидролиз идет и по катиону и по аниону, то число ступеней равно наибольшему из зарядов):
- при гидролизе солей, образованных слабым многокислотным основанием и сильной кислотой, образуются основные соли (содержащие катион металла, анионы ОН– и кислотного остатка, например, FеОНСl2 – гидроксохлорид железа III);
- при гидролизе солей, образованных слабой многоосновной кислотой и сильным основанием, образуются кислые соли (содержащие анионы кислотного остатка, катионы металла и Н+, например, КНСО3 – гидрокарбонат калия).
Гидролиз по второй и, особенно, по третьей ступени выражен незначительно
Пример. Составить уравнения гидролиза и определить реакцию среды в растворе хлорида железа (III).
Реакция гидролиза FеСl3 проходит в три стадии, так как заряд иона железа равен 3+:
1) составим молекулярное, полное и краткое ионное уравнение первой ступени гидролиза:
молекулярное уравнение: FеСl3 + НОН ↔ FеОНСl2 + НСl
полное ионное уравнение: Fе3+ + 3Cl– + НОН ↔ (FеОН)2+ + 2Сl– + H+ + Сl–
краткое ионное уравнение: Fе3+ + НОН ↔ (FеОН)2+ + H+
2) составим молекулярное, полное и краткое ионное уравнение второй ступени гидролиза:
FеОНСl2 +НОН ↔ Fе(ОН)2Сl + НСl
FеОН2+ + 2Сl– + НОН ↔ (Fе(ОН)2)+ + Сl– + H+ + Сl–
FеОН2+ + НОН ↔ (Fе(ОН)2)+ + H+
3) составим молекулярное, полное и краткое ионное уравнение третьей ступени гидролиза:
Fе(ОН)2Сl + НОН ↔ Fе(ОН)3↓ + НСl
Fе(ОН)2+ + Сl– + НОН ↔ Fе(ОН)3↓ + H+ + Сl–
Fе(ОН)2+ + НОН ↔ Fе(ОН)3↓ + H+
4) общее уравнение реакции гидролиза в молекулярной полной и краткой ионной форме имеет вид:
FеСl3 + НОН ↔ Fе(ОН)3↓ + 3НСl
Fе3+ + 3Сl– + 3НОН ↔ Fе(ОН)3↓ + 3H+ + 3Сl–
Fе3+ + 3НОН ↔ Fе(ОН)3↓ + 3H+
Таким образом, гидролиз соли, образованной слабым трехкислотным основанием и сильной кислотой идет по катиону в три стадии, а накопление ионов H+ приводит к тому, что рН < 7.
Степень гидролиза (h) – соотношение числа молекул, подвергшихся гидролизу к общему числу молекул.
В разбавленных растворах гидролиз можно охарактеризовать константой гидролиза (КГ). Так, для соли образованной сильным основанием и слабой кислотой:
KCN + HOH → KOH + HCN
CN– + HOH → OH– + HCN
КГ = [OH–][HCN] / [CN–]∙[HOH]
Концентрация недиссоциированных молекул воды постоянна, тогда
КГ = [OH–]∙[HCN] / [CN–]
Так как [H+][ОН–] = Кводы, то [ОН–] = Кводы / [H+], и преобразуя константу гидролиза получим:
КГ = Кводы [ HCN] / [CN–]∙[H+], т.е. КГ = Кводы / Ккислоты
Аналогично, константа гидролиза соли слабого основания и сильной кислоты выражается соотношением ионного произведения воды и константы диссоциации соответствующего основания: КГ = Кводы / Коснования
Дата добавления: 2015-08-08; просмотров: 1527;
