Электролиты и электролитическая диссоциация
Растворы, проводящие электрический ток, называются растворами электролитов.Существуют две основные причины прохождения электрического тока через проводники: либо за счет переноса электронов, либо за счет переноса ионов. Электронная проводимость присуща, прежде всего, металлам. Ионная проводимость присуща многим химическим соединениям, обладающим ионным строением, например, солям в твердом или расплавленном состояниях, а также многим водным и неводным растворам. Все вещества по их поведению в растворах принято делить на две категории: а) вещества, растворы которых обладают ионной проводимостью (электролиты); б) вещества, растворы которых не обладают ионной проводимостью (неэлектролиты). К электролитам относится большинство неорганических кислот, оснований и солей. К неэлектролитам относятся многие органические соединения, например, спирты и углеводы.
Оказалось, что растворы электролитов обладают более низкими значениями температуры плавления и более высокими температурами кипения по сравнению с соответствующими значениями для чистого растворителя или для раствора неэлектролита в этом же растворителе. Для объяснения этих фактов Аррениус предложил теорию электролитической диссоциации.
Под электролитической диссоциацией понимается распад молекул электролита в растворе с образованием положительно и отрицательно заряженных ионов – катионов и анионов. Например, молекула уксусной кислоты так диссоциирует в водном растворе:
СН3СООН  СН3СОО– + Н+
СН3СОО– + Н+
Процесс диссоциации во всех случаях является обратимым, поэтому при написании уравнений реакции диссоциации применяется знак обратимости  . Различные электролиты диссоциируют на ионы в различной степени. Полнота распада зависит от природы электролита, его концентрации, природы растворителя, температуры.
. Различные электролиты диссоциируют на ионы в различной степени. Полнота распада зависит от природы электролита, его концентрации, природы растворителя, температуры.
Сильные и слабые электролиты. Степень диссоциации. Константа диссоциации. Степенью диссоциации α называют – отношение числа молекул, распавшихся на ионы (n) к общему числу растворенных молекул (n0).
α = (n/n0)∙100
Степень диссоциации может изменяться от 0 до 1, от отсутствия диссоциации до полной диссоциации. В зависимости от величины степени диссоциации различают слабые и сильные электролиты. К слабым электролитам относят вещества, у которых степень диссоциации в 0,1 М растворах меньше 3%; если степень диссоциации в 0,1 М растворе превышает 30%, то такой электролит называют сильным. Электролиты, степень диссоциации которых лежит в пределах от 3% до 30%, называются электролитами средней силы.
К сильным электролитам относятся большинство солей, некоторые кислоты – НСl, НВr, НI, НNО3, НСlO4, Н2SO4 и основания щелочных и щелочноземельных металлов – щелочи LiОН, NаОН, КОН, RbОН, СsОН, Са(ОН)2, Sr(ОН)2, Ва(ОН)2.
Уравнение реакции диссоциации электролита АК на катионы К+ и анионы А– можно в общем виде представить следующим образом:
КА 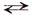 К+ + А–
К+ + А–
и степень диссоциации α в данном случае можно выразить отношением молярной концентрации образовавшихся ионов [К+] или [А–] к первоначальной молярной концентрации электролита [АК]о, т.е.
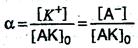
С увеличением концентрации раствора степень диссоциации электролита уменьшается.
Многоосновные кислоты и основания диссоциируют ступенчато – вначале от молекулы отщепляется один из ионов, затем другой и т.д. Каждая ступень диссоциации характеризуется своим значением константы диссоциации.
I ступень: Н2SO4 → Н+ + НSO4–
II ступень: НSO4–  Н+ + SO42–
Н+ + SO42–
Общее уравнение: Н2SO4  2Н+ + SO42–
2Н+ + SO42–
Процесс электролитической диссоциации характеризуют константой диссоциации(К). Так, для реакции КА  К+ + А– константа диссоциации:
К+ + А– константа диссоциации:
К = [К+]∙[ А–]/[КА]
Между константой и степенью электролитической диссоциации существует количественная связь. В приведенном примере общую концентрацию растворенного вещества обозначим с, а степень диссоциации α. Тогда [К+] = [А–] = α∙с и соответственно концентрация недиссоциированных частиц [КА] = (1 – α)с.
Подставив значения в выражение для константы диссоциации, получим соотношение
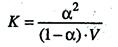 , поскольку молярная концентрация равна C = 1/V, то
, поскольку молярная концентрация равна C = 1/V, то 
Данные уравнения является математическим выражением закона разведения Оствальда: константа диссоциации электролита не зависит от разведения раствора.
Ионное произведение воды. рН раствора. Значение константы диссоциации воды КН2О = 1·10–14. Данную константу для воды называют ионным произведением воды, которое зависит только от температуры.
Согласно реакции Н2О 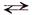 Н+ + ОН–, при диссоциации воды на каждый ион Н+ образуется один ион ОН–, следовательно, в чистой воде концентрации этих ионов одинаковы: [Н+] = [ОН–] = 10–7.
Н+ + ОН–, при диссоциации воды на каждый ион Н+ образуется один ион ОН–, следовательно, в чистой воде концентрации этих ионов одинаковы: [Н+] = [ОН–] = 10–7.
рН = –lg[Н+]
Водные растворы имеют значение рН в интервале от 1 до 14. По соотношению концентраций этих ионов различают три типа сред: нейтральную, кислую и щелочную.
Нейтральная среда – среда, в которой концентрации ионов [Н+] = [ОН–] = 10–7 моль/л (рН = 7).
Кислая среда – среда, в которой концентрация ионов [Н+] больше концентрации ионов [ОН–], т.е. [Н+] > 10–7 моль/л (рН < 7).
Щелочная среда–среда, в которой концентрация ионов [Н+] меньше концентрации ионов [ОН–], т.е. [Н+] < 10–7 моль/л (рН > 7).
Качественно реакцию среды и рН водных растворов электролитов определяют при помощи индикаторов и рН-метра.
Например, если концентрация ионов [H+] = 10–4 моль/л, то рН = – lg10–4 = 4 и среда раствора кислая, а если концентрация ионов [ОН–] = 10–4 моль/л, то [Н+] = К(Н2O) – [ОН–] = 10–14 – 10–4 = 10–10, а рН = – lg10–10 = 10 и среда раствора щелочная.
Произведение растворимости. Растворение твердого вещества в воде прекращается тогда, когда образуется насыщенный раствор, т.е. устанавливается равновесие между твердым веществом и частицами того же вещества, находящимися в растворе. Так, например, в насыщенном растворе хлорида серебра устанавливается равновесие:
AgClтв 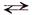 Ag+водн + Сl–водн
Ag+водн + Сl–водн
В насыщенном растворе электролита произведение концентраций его ионов есть величина постоянная при данной температуре и эта величина количественно характеризует способность электролита растворяться, называется она произведением растворимости (ПР).
ПР(АgCl) = [Аg+][Cl–]
Произведение растворимости – это постоянная величина, равная произведению концентраций ионов малорастворимого электролита в его насыщенном растворе. В общем случае для малорастворимого электролита состава AmBn можно записать: AmBn ↔ mA + nB
ПРAmBn = [A]m ∙ [B]n
Зная величины произведений растворимости, можно решать вопросы, связанные с образованием или растворением осадков при химических реакциях, что особенно важно для аналитической химии.
Дата добавления: 2015-08-08; просмотров: 915;
