Диссоциация
Ключевые слова: электролиты, сольватация, степень диссоциации, константа диссоциации, ионная сила раствора, активность ионов, коэффициент активности, закон разбавления Оствальда, факторы, влияющие на степень диссоциации.
 По способности проводить электрический ток все вещества делятся на электролиты (проводящие электрический ток) и неэлектролиты (не проводящие электрический ток). Электролиты -вещества, обладающие ионной проводимостью; их называют проводниками второго рода – прохождение тока через них сопровождается переносом вещества. К электролитам относится большинство неорганических кислот, оснований и солей. В среде высокой диэлектрической проницаемости (спирты, вода и др.) они распадаются на ионы. Процесс распада молекул на ионы называется электролитической диссоциацией:NaCl
По способности проводить электрический ток все вещества делятся на электролиты (проводящие электрический ток) и неэлектролиты (не проводящие электрический ток). Электролиты -вещества, обладающие ионной проводимостью; их называют проводниками второго рода – прохождение тока через них сопровождается переносом вещества. К электролитам относится большинство неорганических кислот, оснований и солей. В среде высокой диэлектрической проницаемости (спирты, вода и др.) они распадаются на ионы. Процесс распада молекул на ионы называется электролитической диссоциацией:NaCl  Na+ + Cl-. Диссоциация электролитов на ионы сопровождается сольватацией, т.е. взаимодействием ионов с полярными молекулами растворителя. Если растворителем является вода, то термин «сольватация» заменяется термином «гидратация».
Na+ + Cl-. Диссоциация электролитов на ионы сопровождается сольватацией, т.е. взаимодействием ионов с полярными молекулами растворителя. Если растворителем является вода, то термин «сольватация» заменяется термином «гидратация».
Количественной характеристикой процесса диссоциации являетсястепень диссоциации (a), которая показывает отношение числа молекул, распавшихся на ионы (Nион), к общему числу растворенных молекул (Nобщ):
a= Nион / Nобщ. По степени диссоциации электролиты делятся:
1) на сильные, которые в 0,1 М растворе имеют a>30%; к ним относятся: почти все соли (кроме HgCl2, СdCl2, Fe(SCN)3, Pb(CH3COO)2 и некоторые другие); сильные минеральные кислоты (HNO3, HCl, H2SO4, HI, HBr, HСlO4); основания щелочных (LiOH, NaOH, KOH, RbOH, CsOH, FrOH) и щелочно-земельных металлов(Ca(OH)2, Sr(OH)2, Ba(OH)2);
2) средние (a = 3 - 30 % в 0,1 М растворах); к ним относятся, например, H3PO4, H2SO3, HF, Mg(OH)2;
3) слабые (a < 3 % в 0,1 М растворах); слабыми электролитами являются H2S, H2CO3, HNO2, HCN, H2SiO3, H3BO3, HClO и др., а также большинство оснований многовалентных металлов, NH4OH и вода.
Сильные электролиты практически нацело диссоциируют на ионы, и этот процесс можно изобразить следующим образом:

 HCl
HCl  H+ + Cl- ; Na2SO4
H+ + Cl- ; Na2SO4  2Na+ + SO42-
2Na+ + SO42-
Для оценки состояния ионов в растворе пользуются активностью – условной (эффективной) концентрацией ионов, в соответствии с которой они действуют в химических процессах. Активность иона а (моль/л) связана с его молярной концентрацией в растворе (См) соотношением: а = f·См, где f - коэффициент активности иона (безразмерная величина).
Коэффициенты активности ионов зависят от состава и концентрации раствора, заряда и природы иона и других условий. Значения коэффициентов активности по рассчитанной ионной силе раствора можно определить с использованием соответствующих таблиц. Ионная сила раствора (Ι) равна полусумме произведений молярных концентрации (См) каждого иона на квадрат его заряда (Z):
Ι = 0,5 (C1Z12 + C2Z22 + … + CnZn2) = 0,5 Σ Ci Zi 2, ( i = от 1 до n)
Слабые электролиты диссоциируют частично и обратимо. В их растворах преобладают не ионы, а молекулы. К равновесию, которое устанавливается в растворе слабого электролита между молекулами и ионами, можно применить законы химического равновесия и записать константу равновесия, которая называется константой диссоциации (КД) и приводится в таблицах. Константа диссоциации характеризует силу электролита: чем больше величина КД., тем сильнее электролит, и наоборот.
 HNO2
HNO2  H+ + NO2– (уравнение электролитической диссоциации)
H+ + NO2– (уравнение электролитической диссоциации)
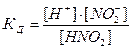
 1, где [H+], [NO2-], [HNO2] – молярные равновесные концентрации соответствующих частиц в растворе, КД– константа диссоциации азотистой кислоты HNO2
1, где [H+], [NO2-], [HNO2] – молярные равновесные концентрации соответствующих частиц в растворе, КД– константа диссоциации азотистой кислоты HNO2
Равновесия в слабых электролитах подчиняются закону разведения Оствальда. Если общая молярная концентрация слабого электролита, например, слабой кислоты HNO2 равна С (моль/л), тогда концентрация ионов H+ и NO2- будет определяться выражением [H+] = [NO2-] = С·a (моль/л), а концентрация недиссоциированного электролита [HNO2] = (С-С·a). Тогда
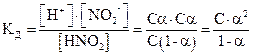 . При a << 1 получим КД = С.a2 и
. При a << 1 получим КД = С.a2 и 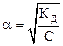 .
.
Степень диссоциации зависит от природы электролита, его концентрации, природы растворителя, присутствия в растворе одноименных ионов, температуры. Для одного и того же электролита при данной температуре степень диссоциации (a) увеличивается с разбавлением раствора; при больших разбавлениях электролит полностью диссоциирует (a®1). С увеличением температуры a также увеличивается.
Контрольные вопросы:
1. Какие вещества называются электролитами и неэлектролитами?
2. Дайте определение кислотам, основаниям и солям с точки зрения теории электролитической диссоциации.
3. Что такое степень и константа диссоциации?
4. В каких случаях термин «концентрация» заменяется термином «активность»?
Список рекомендуемой литературы:
1. Глинка Н.Л. Общая химия: учеб. пособие для вузов / Н.Л. Глинка. - М.: КНОРУС, 2009. - С. 237 - 252.
2. Коровин Н.В. Общая химия: учебник для технических направл. и спец. вузов - 7-е изд., испр. - М.: Высшая школа, 2006. - С. 210 - 243.
С.Б. Денисова, О.Б.Чалова
Дата добавления: 2015-08-08; просмотров: 1416;
