Расчет рН в растворах сильных и слабых оснований
1. Диссоциация сильного основания (LiOH, NaOH, KOH, RbOH, CsOH, FrOH, Ca(OH)2, Sr(OH)2, Ba(OH)2) протекает практически полностью:
 NaOH
NaOH  Na+ + OH– (сильное основание - сильный электролит)
Na+ + OH– (сильное основание - сильный электролит)
Можно считать, что [ОH-] = Сщел, где Сщел - молярная концентрация сильного основания (щелочи). Расчет рН раствора сильного основания проводят по схеме: рОН = - lgаОН- = - lgfОН-[ОH-]; рН = 14 – рОН.
2. Диссоциация слабого основания протекает незначительно, частично:
 NH3∙H2O
NH3∙H2O  NH4+ + OH– (слабое основание - слабый электролит)
NH4+ + OH– (слабое основание - слабый электролит)
Молярную концентрацию гидроксид – ионов [ОH-] в растворе слабого основания рассчитывают по закону разведения Оствальда:
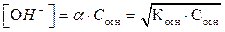 , где α – степень диссоциации основания, Сосн –
, где α – степень диссоциации основания, Сосн –
молярная концентрация основания, Косн – константа диссоциации основания, характеризует силу основания: чем меньше константа диссоциации, тем слабее основание.
Контрольные вопросы:
1. Диссоциация воды, ионное произведение воды.
2. Водородный показатель (рН), гидроксильный показатель (рОН).
3. Расчет рН растворов сильных кислот и оснований.
4. Расчет рН растворов слабых кислот и оснований.
Список рекомендуемой литературы:
1. Глинка Н.Л. Общая химия: учеб. пособие для вузов / Н.Л. Глинка. - М.: КНОРУС, 2009. - С. 258.
2. Коровин Н.В. Общая химия: учебник для технических направл. и спец. вузов - 7-е изд., испр. - М.: Высшая школа, 2006. - С. 215-218, 224 – 231.
С.Б. Денисова, Е.А. Буйлова, Д.Р. Галиева
Дата добавления: 2015-08-08; просмотров: 1420;
