Расчет рН в растворах сильных и слабых кислот
1. Поскольку диссоциация сильной кислоты (HNO3, HCl, H2SO4, HI, HBr, HСlO4) протекает практически полностью, можно считать: [H+] = Скисл., где Скисл - молярная концентрация кислоты.
 HNO3
HNO3  H+ + NO3– (сильная кислота - сильный электролит)
H+ + NO3– (сильная кислота - сильный электролит)
Расчет рН сильной кислоты проводят по уравнению
рН = - lgаН+ = - lgfН+[H+], где аН+ - активная концентрация, моль/л.
2. При расчете рН слабых электролитов обычно принимают ионную силу раствора (I) равной нулю, коэффициент активности (f) равным 1 и рН = - lg[H+].
 HNO2
HNO2  H+ + NO2– (слабая кислота - слабый электролит)
H+ + NO2– (слабая кислота - слабый электролит)
Концентрация ионов водорода в растворе слабых кислот определяют по закону разведения Оствальда:
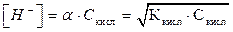 ,где α – степень диссоциации кислоты, Скисл – молярная концентрация кислоты, Ккисл – константа диссоциации кислоты, характеризует силу кислоты: чем меньше константа диссоциации, тем слабее кислота.
,где α – степень диссоциации кислоты, Скисл – молярная концентрация кислоты, Ккисл – константа диссоциации кислоты, характеризует силу кислоты: чем меньше константа диссоциации, тем слабее кислота.
Основание(определение по Аррениусу) - это химическое соединение, которое в водном растворе частично или полностью диссоциирует на положительно заряженные ионы (простые или сложные) и отрицательно заряженные гидроксид-ионы.
Дата добавления: 2015-08-08; просмотров: 2170;
