Направление ионно-обменной реакции между двумя электролитами в растворе определяется возможностью образования их ионами осадка, газа или слабого электролита.
1. Образование малорастворимого соединения, выпадающего в виде осадка: AgNO3 + NaCl = AgCl↓ + NaNO3 (молекулярное уравнение)
Ag+ + NO3 – + Na+ + Cl – = AgCl↓ + Na+ + NO3 – (полное ионное уравнение)
Ag+ + Cl – = AgCl↓ (сокращенное ионное уравнение ).
2. Образование газообразного вещества, удаляемого из раствора:
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑
2Na+ + CO32 – + 2H+ + SO42 – = 2Na+ + SO42 – + H2O + CO2↑
CO32 – + 2H+ = H2O + CO2↑
3. Образование растворимого, но мало диссоциированного вещества, например, воды, слабой кислоты или слабого основания:
CH3COONa + H2SO4 = Na2SO4 + CH3COOH
CH3COO –+ Na+ = 2Na+ +SO42 –+ CH3COOH
CH3COO – + H+ = CH3COOH;
4. Образование устойчивой комплексной частицы – молекулы или иона:
HgI2 + 2KI = K2[HgI4]
Hg2+ + 2I – + 2K+ + 2I – = 2K+ + [HgI4]2 –
Hg2+ + 4I – = [HgI4]2 –
Реакциями нейтрализации называются обменные реакции взаимодействия кислот и оснований, в результате которых образуются соль и вода, например: NaOH + HCl = NaCl + H2O или OH – + H+ = H2O.
При нейтрализации сильного основания сильной кислотой равновесие практически полностью смещено в сторону образования воды. Реакции нейтрализации при взаимодействии кислот и оснований, различающихся по силе, не доходят до конца вследствие протекания обратной реакции гидролиза соли, например: СН3СООН + NaOH 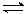 CH3COONa + Н2О
CH3COONa + Н2О
СН3СООН + ОН- 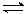 СН3СОО- + Н2О.
СН3СОО- + Н2О.
Реакции нейтрализации экзотермические и протекают с выделением тепла.
Контрольные вопросы:
1. Произведение растворимости.
2. Растворимость и ее связь с произведением растворимости.
3. Условия образования и растворения осадков.
4. Ионно-обменные реакции.
5. Направление протекания ионно-обменных реакций.
6. Реакции нейтрализации.
Список рекомендуемой литературы:
1. Глинка Н.Л. Общая химия: учеб. пособие для вузов / Н.Л. Глинка. - М.: КНОРУС, 2009. - С. 252 - 258.
2. Коровин Н.В. Общая химия: учебник для технических направл. и спец. вузов - 7-е изд., испр. - М.: Высшая школа, 2006. - С. 232 - 234.
А.Т. Чанышева
Дата добавления: 2015-08-08; просмотров: 976;
