Лекция 13. Произведение растворимости. Ионно-обменные реакции
Ключевые слова:малорастворимые сильные электролиты, произведение растворимости, растворимость, ионно-обменные реакции, реакция нейтрализации.
Насыщенный раствор находится в равновесии с твердой фазой растворяемого вещества. Гетерогенное равновесие «осадок  насыщенный раствор» характеризует константа равновесия. Если малорастворимый электролит диссоциирует по уравнению AmBn
насыщенный раствор» характеризует константа равновесия. Если малорастворимый электролит диссоциирует по уравнению AmBn  mAn+ + nBm-,
mAn+ + nBm-,
то выражение для константы равновесия – произведения растворимости ( 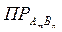 ) – будет иметь вид: Кр =
) – будет иметь вид: Кр = 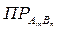 = [An+]m·[Bm-]n, где [An+], [Bm-] – молярные концентрации ионов An+ и Bm- соответственно, в насыщенном растворе. Например, для равновесия: СaSO4
= [An+]m·[Bm-]n, где [An+], [Bm-] – молярные концентрации ионов An+ и Bm- соответственно, в насыщенном растворе. Например, для равновесия: СaSO4  Ca2+ + SO42–
Ca2+ + SO42–
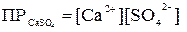 = 3,72∙10-5 [моль2/л2] (при 25оС)
= 3,72∙10-5 [моль2/л2] (при 25оС)
Следовательно, для насыщенного водного раствора малорастворимого электролита произведение равновесных молярных концентраций его ионов в степенях, равных стехиометрическим коэффициентам, есть величина постоянная при данной температуре, и называемая произведением растворимости.Зная произведение растворимости (ПР), можно вычислить растворимость вещества (S) при данных условиях, т.е. концентрацию насыщенного раствора в [моль/л] и в [г/л]. Например, для бинарных электролитов (ВaSO4, СaСO3, AgI и др.) растворимость [моль/л] численно равна: 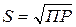 .
.
В ненасыщенном растворе возможно растворение дополнительного количества вещества, так как концентрация меньше, чем в насыщенном. Из перенасыщенного раствора осадок образуется, так как его концентрация больше, чем в насыщенном.
Отсюда вытекают условия образования и растворения осадка:
1) если [An+]m·[Bm-]n = ПРAmBn, то осадок находится в равновесии с раствором (насыщенный раствор);
2) если [An+]m·[Bm-]n > ПРAmBn, то осадок выпадает (перенасыщенный раствор);
3) если [An+]m·[Bm-]n < ПРAmBn, то осадок растворяется (ненасыщенный раствор).
Важным следствием является правило, используемое для более полного удаления из раствора какого-либо иона: растворимость малорастворимого электролита уменьшается при введении хорошо растворимого электролита, имеющего одноименный (общий) ион с малорастворимым электролитом.
В водных растворах электролитов химические реакции протекают с участием ионов, такие реакции называются ионно-обменными, а уравнения этих реакций – ионными уравнениями.
В ионных уравнениях реакций формулы сильных электролитов записываются в виде ионов, формулы слабых электролитов, осадков и газов – в виде молекул.
Дата добавления: 2015-08-08; просмотров: 1027;
