Способы выражения концентрации (состава) растворов
Количественный состав раствора чаще всего выражается с помощью понятия «концентрации», т.е. содержание растворенного вещества в единице массы или объема. 1.
1. Массовая доля (ω) – это отношение массы растворенного вещества к общей массе раствора. Для бинарного раствора:
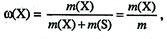
где ω(Х) – массовая доля растворенного вещества X (% или доли единицы); m(Х) – масса растворенного вещества X, г; m(S) – масса растворителя S, г; т – масса раствора, г.
2. Молярная концентрация илимолярность (СМ)показывает число молей растворенного вещества, содержащегося в 1 литре раствора:
СМ(Х) = ν(Х)/V = m / (M·V)
где СМ(Х) – молярная концентрация растворенного вещества X, моль/л; ν(Х) – количество растворенного вещества X, моль; V – объем раствора, л.
Размерность молярной концентрации (моль/л) иногда обозначается М, так: запись 2М NaOH означает, что речь идет о растворе гидроксида натрия с молярной концентрацией 2 моль/л.
Раствор, в 1 л которого содержится 1 моль растворенного вещества, называется одномолярным (обозначается 1 М); 0,1 моль растворенного вещества, называется децимолярным (обозначается 0,1 М); 0,01 моль растворенного вещества, называется сантимолярным (обозначается 0,01 М).
3. Мольная доля (N) растворенного вещества – безразмерная величина, равная отношению количества растворенного вещества к общему количеству веществ в растворе:
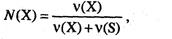
где N(X) – мольная доля растворенного вещества X (моль); ν(х) – количество растворенного вещества X, моль; ν(S) – количество вещества растворителя S, моль.
4. Моляльность или моляльная концентрация (Сm) – отношение количества растворенного вещества (ν), приходящееся на 1000 г растворителя:
Сm = ν ∙ 1000 / m1 = m2 ∙ 1000 / (М ∙ т1) (моль/кг),
где т1 – масса растворителя, т2 – масса растворенного вещества, М – молярная масса растворенного вещества.
5. Нормальность или нормальная (эквивалентная) концентрация (СН) – отношение числа эквивалентов (Э) или эквивалентных масс (mЭ) растворенного вещества к объему раствора:
СН = m / (mЭ ∙ V)или СН =m / (М ∙ Э ∙ V)(моль/л; г∙экв/л),
где m – масса растворенного вещества, mЭ – эквивалентная масса растворенного вещества, V – объем раствора, Э – эквивалент, М – молярная масса растворенного вещества.
Раствор, в 1 л которого содержится 1 эквивалентная масса растворенного вещества, называется однонормальным (обозначается 1 н); 0,1 эквивалентная масса растворенного вещества, называется децинормальным (обозначается 0,1 н); 0,01 эквивалентная масса растворенного вещества, называется сантинормальным (обозначается 0,01 н).
Вещества реагируют в эквивалентных количествах. Объемы растворов реагирующих веществ обратно пропорциональны их нормальностям:
V1 ∙ CH1 = V2 ∙ CH2 или V1 / V2 = CH2 / CH1
(V1 ∙ Н1 = V2 ∙ Н2 или V1 / V2 = Н2 / Н1)
где V1 и CH1 (Н1)– объем и нормальность первого раствора, V2 и CH2 (Н2)– объем и нормальность второго раствора.
6. Титр (Т)– масса вещества (m), содержащегося в 1 мл раствора (V):
Т = m / V (г/мл)
Концентрацию насыщенного раствора часто выражают через растворимость вещества.
Растворимость вещества s показывает максимальную массу вещества, которая может раствориться в 100 г растворителя:
s = (mв-ва / mр-ля) · 100
Растворимость числено равна концентрации (моль/л) того иона, содержание которого в данном веществе равно концентрации насыщенного раствора. Так, если концентрация OH– в Mg(OH)2 равна 4,12∙10–4, следовательно, концентрация Mg2+ равна 2,6∙10–4.
Солевой эффект – повышение растворимости малорастворимых солей при добавлении к ним сильных электролитов.
Пересчет одного количественного выражения состава раствора в другое можно производить, пользуясь формулами связи этих физических величин. Так,
СМ = 10 ∙ ρ ∙ ω / М
СН = 10 ∙ ρ ∙ ω / mЭ
Т = СН ∙ Э / 1000
Сравнение формул для определения молярной и нормальной концентраций
СМ = ν /V = m / (M ∙ V)
СН = m / (М ∙ Э ∙ V)
показывает, что если эквивалент растворенного вещества Э = 1 моль, СМ = СН. Эквивалент, равный единице, имеют растворы одноосновных кислот (HCl, HNO3 и т.д.), однокислотных оснований (NaOH, KOH и т.д.), солей катион и анион которых однозарядные (KCl, NaNO3 и т.д.). Если же эквивалент растворенного вещества не равен 1 моль, то формула соотношения молярной и нормальной концентраций имеет вид: СМ = СН· Э.
Дата добавления: 2015-08-08; просмотров: 1694;
