Ионная связь. Ионная связь – электростатическое притяжение между ионами, образованными путем полного смещения электронной пары к одному из атомов.
Ионная связь – электростатическое притяжение между ионами, образованными путем полного смещения электронной пары к одному из атомов.
Na+ Cl–, NH4+ OH–
Ионная связь – предельный случай полярной ковалентной связи (разность ЭО атомов >1,7 по шкале Полинга). Даже такая «предельно ионная» молекула, как хлорид цезия, фактически не является ионной на 100 %.
В отличие от ковалентной связи, ионная связь не обладает направленностью (т.к. электрическое поле иона обладает сферической симметрией) и поэтому взаимодействие между ионами осуществляется независимо от направления.
Ионная связь не обладает насыщаемостью (к данному иону присоединяется различное число ионов противоположного знака) и характеризуется значительной полярностью.
Энергетически наиболее выгодно, когда каждый ион окружен максимальным числом ионов противоположного знака. Однако из-за отталкивания одноименных ионов друг от друга устойчивость системы достигается лишь при определенной взаимной координации ионов. Подобная взаимная координация ионов достигается при образовании простой кубической кристаллической решетки хлорида натрия, в узлах которой находятся ионы натрия (темные кружочки) и ионы хлора (светлые кружочки).
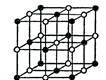
Таким образом, весь кристалл поваренной соли представляет собой как бы одну огромную макромолекулу, состоящую из огромного числа ионов (Nа+Сl–)n. Поэтому для ионных соединений понятие простых двухатомных молекул типа NаСl или СsBr при обычных условиях теряет смысл. Отдельные молекулы типа NаСl существовать могут в газовой фазе при очень высоких температурах (температура кипения NаСl +1450 °С) и низких давлениях, когда вероятность столкновения между молекулами мала.
У атомов одних элементов преимущественно проявляется тенденция к потере электронов с превращением в положительно заряженные ионы (катионы), атомы же других элементов, наоборот, стремятся приобрести электроны, переходя при этом в отрицательно заряженные ионы (анионы).
Дата добавления: 2015-08-08; просмотров: 889;
