Межмолекулярные взаимодействия
Электрически нейтральные атомы и молекулы способны к дополнительному взаимодействию друг с другом.
Водородная связь – связь между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы (F, O, N, реже Cl, S и др.). Водородная связь имеет частично электростатический, частично донорно-акцепторный характер.
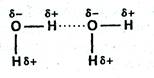
Взаимодействие между молекулами воды оказывается достаточно сильным, таким, что даже в парах воды присутствуют димеры и тримеры состава (Н2О)2, (Н2О)3 и т.д. В растворах же могут возникать длинные цепи ассоциатов (Н2О)n:
Водородные связи возникать как между различными молекулами, так и внутри молекулы, если в этой молекуле имеются группы с донорной и акцепторной способностями. Так, именно внутримолекулярные водородные связи играют основную роль в образовании пептидных цепей, которые определяют строение белков. Одним из наиболее известных примеров влияния внутримолекулярной водородной связи на структуру является дезоксирибонуклеиновая кислота (ДНК). Молекула ДНК свернута в виде двойной спирали. Две нити этой двойной спирали связаны друг с другом водородными связями.
Водородная связь имеет промежуточный характер между валентным и межмолекулярным взаимодействием. Она связана с уникальными свойствами поляризованного атома водорода, его малыми размерами и отсутствием электронных слоев.
Энергия водородной связи (8-40 кДж/моль) значительно меньше энергии ковалентной связи (150-400 кДж/моль), но этой энергии достаточно, чтобы вызвать ассоциацию молекул.
Ван-дер-ваальсова связь (межмолекулярное взаимодействие). Все вещества в зависимости от внешних условий (температуры и давления) могут существовать в различных агрегатных состояниях. Так, при низких температурах оказывается возможным «согласованное» движение электронов, при котором у молекулы могут возникать наведенные диполи без передачи атомами электронов, и между ними возникают так называемые индукционные силы притяжения. Такой вид взаимодействия называется ван-дер-ваальсовой связью. Энергия такой связи намного (в сотни раз) меньше энергий ковалентных, ионных или металлических. Вандерваальсовы силы обусловливают притяжение молекул и агрегацию вещества, превращение газообразного вещества в жидкое и далее в твердое состояние.
Связь между молекулами может осуществляться как электростатическим, так и донорно-акцепторным взаимодействием, что обусловливает разнообразие сложных соединений и их характерных свойств – так образуются комплексные соединения, рассматриваемые в отдельной главе.
Дата добавления: 2015-08-08; просмотров: 1097;
