Функции. Тромбоциты участвуют в аллергических реакциях, а также в свёртывании крови и восстановлении целостности стенки сосуда
Тромбоциты участвуют в аллергических реакциях, а также в свёртывании крови и восстановлении целостности стенки сосуда, секретируя ангиогенные факторы. При активации рецепторов к Fc–фрагменту IgE тромбоциты секретируют факторы, обладающие высокой дегрануляционной активностью, — фактор тромбоцитов PF4 и фактор высвобождения гистамина HRF, стимулирующие выделение содержимого гранул тучных клеток. В физиологических условиях тромбоциты не прикрепляются к эндотелию сосуда. Частично это связано с тем, что эндотелиальные клетки вырабатывают простациклин PGI2, препятствующий адгезии тромбоцитов к стенке сосуда. При нарушении целостности сосудистой стенки формируется тромб (рис. 6-11). Практически немедленно после повреждения происходит сужение просвета сосудов, и запускается каскад биохимических реакций тромбообразования. Тромбоциты способствуют образованию тромба, создавая поверхность для сборки комплекса белков коагуляции. В повреждённом участке сосуда происходят адгезия и агрегация тромбоцитов. Ранние события агрегации — изменение формы и первичная агрегация — обратимы, так что слабо агрегированные тромбоциты могут отделяться от гемостатических пробок и возвращаться в кровоток.
Для активации тромбоцитов и тромбообразования необходим тканевый фактор, основное количество которого поступает из повреждённой сосудистой стенки в кровь. Часть тканевого фактора происходит из клеток крови и присутствует в крови; этот тканевый фактор опосредует разрастание тромба. Доставка тканевого фактора и его накопление в развивающемся тромбе зависит от селектина P тромбоцитов и циркулирующих в крови происходящих из лейкоцитов микрочастиц, экспрессирующих как молекулу адгезии PSGL-1, так и тканевый фактор. При повреждении стенки сосуда и начале тромбообразования активированные тромбоциты экспрессируют P селектин. Циркулирующие микрочастицы захватываются тромбоцитами в составе тромба в результате взаимодействия PSGL-1 микрочастиц с P селектином тромбоцитов, что ведёт к концентрированию тканевого фактора в тромбе. Тканевый фактор запускает коагуляционный каскад, приводящий к образованию фибриновых нитей и разрастанию тромба.
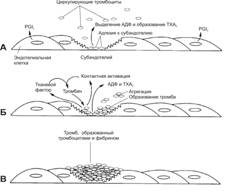
Рис. 6-11. Образование тромба. А — образование тромба начинается с прикрепления тромбоцитов к макромолекулам базальной мембраны или подэндотелиальной соединительной ткани. Свойства интактного эндотелия совместно с секретируемым эндотелиальными клетками простациклином PGI2 препятствуют адгезии тромбоцитов. Однако, тромбоциты прикрепляются к коллагену подэндотелиальной соединительной ткани в местах повреждения стенки сосуда. Эта адгезия вызывает активацию и агрегацию тромбоцитов с последующим освобождением АДФ и образованием тромбоксана TXА2. Б — образование тромбоксана TXА2 и дальнейшее выделение АДФ стимулируют дополнительную агрегацию тромбоцитов в месте повреждения до тех пор, пока не образуется тромбоцитарная пробка. Освобождение тканевого фактора и контактная активация также запускают процессы внешней и внутренней коагуляции, в результате которых образуется тромбин. В — формирующиеся нити фибрина вплетаются в тромб и стабилизируют его. [17]
Адгезия. В адгезии тромбоцитов участвуют коллаген, гликопротеин Ib, фактор фон Виллебранда, Ca2+ и другие факторы (например, тромбоспондин, фибронектин). Коллаген базальной мембраны эндотелия и подэндотелиальной соединительной ткани служит субстратом для адгезии тромбоцитов и стимулирует их последующую агрегацию. Гликопротеин Ib тромбоцита взаимодействует с фактором фон Виллебранда — комплексом белков, содержащихся в основном в -гранулах тромбоцитов, частично в эндотелии и его базальной мембране.
Первичная агрегация. Вслед за адгезией начинается агрегация тромбоцитов. При этом Ca2+‑зависимый трансмембранный гликопротеин IIb‑IIIa связывается с фибриногеном. Фибриноген опосредует связывание тромбоцитов, обеспечивая их агрегацию (рис. 6-11). Агрегацию запускают различные вещества: адреналин (через‑адренорецепторы в плазматической мембране тромбоцитов), АДФ (из ‑гранул), тромбин.
Тромбин — сериновая протеаза, образуемая в участке повреждения эндотелия сосудов. Тромбин участвует в активации тромбоцитов, увеличивает проницаемость эндотелия, способствует изменению формы эндотелиальных клеток (от плоских — к более высоким), стимулирует мобилизацию молекул адгезии в апикальной мембране эндотелиальных клеток и продукцию эндотелием цитокинов и простагландинов. Тромбин служит митогеном для лимфоцитов и фактором хемотаксиса — для моноцитов.
Вторичная агрегация. По мере прикрепления всё большего количества тромбоцитов к подэндотелиальной соединительной ткани они активируются. Активированные тромбоциты приобретают шаровидную форму, образуют метаболиты арахидоновой кислоты и секретируют содержимое - и ‑гранул. При этом в сыворотке увеличивается содержание серотонина. Серотонин ограничивает поток крови в повреждённой области.
Свёртывание крови (рис. 6-12). Тромбоциты высвобождают фибриноген в дополнение к уже присутствующему в плазме в норме. Фибриноген с помощью факторов свёртывания конвертируется в фибрин, образующий плотную фиброзную основу, к которой прикрепляется всё больше тромбоцитов и других клеток крови.

Рис. 6-12. Гемокоагуляционный каскад. Активация фактора XII запускает внутренний механизм; высвобождение тканевого фактора и активация фактора VII запускают наружный механизм коагуляции. Оба пути приводят к активации фактора Х. [21]
Судьба тромба. Тромб первоначально выступает в просвет сосуда, но позже он сокращается и уплотняется. По мере заживления стенки сосуда тромб удаляется при помощи плазмина. Плазмин образуется из плазминогена, синтезируемого в печени. Дополнительно из ‑гранул тромбоцитов выделяются ферменты, разрушающие тромб. Стенка сосуда восстанавливается благодаря пролиферации ГМК и фибробластов, накоплению нового соединительнотканного матрикса, восстановлению эндотелия.
Дефицит и/или дефекты тромбоцитов приводят к удлинению времени кровотечения и геморрагическому диатезу. Тромбоцитопения (пониженное содержание тромбоцитов в периферической крови) — наиболее частая причина патологической кровоточивости. Тромбоцитопатия — состояние, характеризующееся нормальным количеством тромбоцитов, но не способных адекватно участвовать в гемостазе. Вызванная лекарственными препаратами дисфункция тромбоцитов — наиболее частая причина тромбоцитопатий. Например, аспирин ингибирует синтез тромбоксана TXА2, что приводит к появлению в крови тромбоцитов с нарушенными адгезионными свойствами. При большом количестве дефектных тромбоцитов удлиняется время кровотечения, образуются геморрагии, усиливаются кровотечения при травмах. Эффект препарата сохраняется до полной замены дефектных клеток новой популяцией (обычно в течение 3–7 суток). Врождённые формы тромбоцитопатии — тромбастения Глянцманна, синдром Бернара—Сулье. Расстройства системы коагуляции (коагулопатии) можно разделить на наследственные и приобретённые. Наследственные заболевания обычно обусловлены дефектом одного из факторов коагуляции.
Аномалии формирования пула тромбоцитов возникают при элиминации тромбоцитов из кровотока; наиболее частая причина — избыточное депонирование в селезёнке. При очень больших размерах селезёнки возможно депонирование 90% всех тромбоцитов; оставшиеся в периферическом кровотоке 10% имеют нормальную продолжительность циркуляции.
Усиленное разрушение тромбоцитов на периферии — наиболее распространённая форма тромбоцитопений, характеризуется укороченным периодом жизни тромбоцитов и увеличенным количеством мегакариоцитов костного мозга; эти расстройства обозначают как иммуннаяили неиммуннаятромбоцитопеническая пурпура.
Иммуннаятромбоцитопеническая пурпура обусловленасинтезом антитромбоцитарных АТ:
посттрансфузионная,
лекарственная (например, вызванная хинидином),
обусловленная сепсисом (частота развития до 70%),
в сочетании с системной красной волчанкой и другими аутоиммунными заболеваниями.
Неиммунная тромбоцитопеническая пурпура:
инфекции (например, вирусные или малярия),
массивные переливания консервированной крови с низким содержанием тромбоцитов,
как проявление синдрома диссеминированного внутрисосудистого свёртывания,
как часть синдрома тромботической тромбоцитопенической пурпуры (ТТП). Причиной тромботической тромбоцитопенической пурпуры являются мутации гена протеазы ADAMTS13 семейства ADAMTS (ADisintegrin-like And Metalloprotease domain with Thrombospondin type 1 motifs). В норме молекулы ADAMTS13, циркулирующие в крови, прикрепляются к очень длинным мультимерам фактора фон Виллебранда, секретируемым в виде длинных лент стимулированными эндотелиальными клетками, при этом мультимеры фактора фон Виллебранда остаются прикреплёнными к эндотелию. ADAMTS13 разрезают эти длинные ленты на короткие фрагменты (в участке 842Tyr-843Met доменов A2). Тромбоциты не контактируют с такими фрагментами, поскольку в них скрыты тромбоцит-связывающие участки. У больных с ТТП (наследственной или приобретённой) наблюдается недостаточность ADAMTS13. В результате длинные ленты мультимеров фактора фон Виллебранда, прикреплённые к эндотелиальной клетке, остаются неразрезанными; проплывающие мимо с потоком крови тромбоциты прилипают к мультимерам; в итоге формируя тромбы.
Наследственные коагулопатии — дефекты фактора VIII. Гемофилия А составляет 60-80% подобных состояний. Классическая Х-сцепленная рецессивная патология, носители дефектного гена — женщины, болеют мужчины. Болезнь фон Виллебранда — гетерогенное заболевание.
Другие наследственные нарушения коагуляции встречаются редко. Гемофилия В (дефицит фактора IХ) по клиническим проявлениям практически идентична гемофилии А. Дефицит фактора ХI — аутосомно-рецессивная коагулопатия с более лёгкими, чем при гемофилиях, клиническими проявлениями.
Приобретённые коагулопатии. Их патогенез сложнее, они могут быть обусловлены сочетанием недостаточности факторов свёртывания и другими расстройствами.
Витамин К-зависимые коагулопатии. Недостаточность функции печени может сопровождаться коагулопатией вследствие нарушения синтеза плазменных факторов свёртывания (например, II, VII, IХ, Х). Последние этапы синтеза этих факторов происходят в печени путём -карбоксилирования остатков глутаминовой кислоты. Витамин К выступает при этом как кофактор. Нарушение всасывания витамина К может встречаться при обструкции желчевыводящих путей, болезнях кишечника. Дефицит поступления с пищей витамина К особенно часто наблюдают в отделениях интенсивной терапии, при несбалансированном питании; при антибиотикотерапии, приводящей к гибели нормальной микрофлоры ЖКТ, служащей альтернативным источником витамина К. Лекарственные средства могут блокировать метаболизм витамина К. В этом плане наиболее специфичен антикоагулянт кумарин, применяемый при лечении заболеваний с повышенным тромбообразованием.
Диссеминированное внутрисосудистое свёртывание (ДВС) — часто встречающаяся приобретённая коагулопатия; развивается вторично при различных патологических процессах. Активация внутреннего пути коагуляции вследствие повреждения эндотелия (например, при сепсисе, вызванном грамотрицательной флорой; при менингококцемии, виремии). Активация внешнего пути за счёт аномального поступления тканевых тромбопластинов в кровеносное русло (например, при акушерских осложнениях, карциноматозе, обширной травме). Активизация коагуляционного каскада приводит к чрезмерному образованию тромбина, в микрососудистом русле образуются микротромбы, возникают нарушения циркуляции.
Патология печени приводит к комплексной коагулопатии с вовлечением многих факторов свёртывания. Ухудшается синтез витамин-К-зависимых коагуляционных факторов, фибриногена, антитромбина III, плазминогена и т.д. При снижении клиренса продуктов деградации фибрина и активации факторов коагуляции может развиться ДВС-подобное состояние. Портальная гипертензия может приводить к спленомегалии и чрезмерному депонированию тромбоцитов с развитием тромбоцитопении. Накопление продуктов деградации фибрина вызывает нарушение функции тромбоцитов (тромбоцитопатию).
Патологические ингибиторы свёртывания. Наиболее часто встречается ингибитор волчаночного типа (волчаночный антикоагулянт); впервые обнаружен при системной красной волчанке, но встречается и при других состояниях. Специфические ингибиторы свёртывания — АТ, специфичные для отдельных коагуляционных белков. Наиболее часто встречают АТ к фактору VIII.
Другие приобретённые расстройства свёртывания могут сопровождать различные заболевания и состояния. Нефротический синдром (вследствие потери коагуляционных белков почками, особенно — фактора IХ). Экстракорпоральное кровообращение (полагают, что происходит частичная активация системы свёртывания, и развивается ДВС). Массивные переливания препаратов крови (при кровотечении происходит потеря нормальной крови, замещаемой консервированной кровью с низким содержанием факторов свёртывания и тромбоцитов).
Дата добавления: 2015-07-07; просмотров: 1593;
