ГРУППА ВЕЩЕСТВ, ИЗОЛИРУЕМЫХ ИЗ БИОЛОГИЧЕСКОГО МАТЕРИАЛА ЭКСТРАКЦИЕЙ И СОРБЦИЕЙ 3 страница
5.3.2.4. Высокоэффективная жидкостная хроматография (ВЭЖХ)
ВЭЖХ (жидкостная хроматография высокого давления) является вариантом колоночной хроматографии, где элюент подается в колонку под высоким давлением, что ускоряет проведение анализа. Разделение веществ проводится на колонках, заполненных мелкодисперсным сорбентом.
При работе с колонками, заполненными силикагелем, в качестве элюента используются углеводороды, иногда с добавлением небольшого количества спирта или других растворителей (нормальнофазный вариант).
В обращеннофазном варианте к силикагелю прививают гидрофобную фазу – обычно это углеводороды с большим числом углеродных атомов, например, С18, в этом случае в качестве элюента используются смеси метанола или ацетонитрила с водой или буферными растворами.
В качестве детекторов обычно применяют детектор с переменной (от 190 до 900 нм) или с фиксированной длиной волны. Могут быть использованы и другие детекторы – рефрактометрический, флуорометрический, ионизационно-пламенный, электрохимический, диодно-матричный, масс-селективный и т.п.
Выходящие из колонки вещества регистрируются на хроматограмме в виде ряда хроматографических пиков. Идентификацию веществ проводят по параметрам удерживания (время выхода) и спектральным отношениям на разных длинах волн по отношению к опорной (базовой). Количественное определение проводится по площади пика исследуемого вещества, которая прямо пропорциональна количеству вещества в пробе. При этом предварительно строится калибровочный график с использованием методов абсолютной градуировки или внутреннего стандарта.
Метод ВЭЖХ может быть использован в качестве общего и частного скрининга. Он позволяет сочетать изолирование и очистку вещества с его идентификацией и количественным определением.
Значительным преимуществом этого метода перед ГЖХ является возможность анализа термолабильных нелетучих соединений с малой и большой молекулярной массой. Особенно удобен метод ВЭЖХ для работы в клинических лабораториях токсикологических центров при исследовании билогических жидкостей.
5.3.3. Спектральные скрининговые методы
Для скрининга лекарственных средств могут быть применены:
1. Абсорбционная спектроскопия в видимой и УФ-областях спектра.
2. ИК-спектроскопия.
3. Спектроскопия ЯМР (ядерного магнитного резонанса).
4. МС (масс-спектрометрия).
Из перечисленных методов наиболее широко применяется метод абсорбционной спектроскопии в видимой и УФ-областях спектра. Это связано с его доступностью и в то же время достаточной информативностью, чувствительностью.
5.3.3.1. Абсорбционная спектроскопия
Поглощение (абсорбция) веществом света, т.е. потока фотонов или электромагнитного излучения, в видимой или УФ-области спектра связано с переходом электронов внешних орбиталей (валентных электронов) из основного состояния (с меньшей энергией) в возбужденное состояние (с большей энергией). При этом энергия поглощенного фотона:
D Е = Е1- Е0, где
D Е – энергия поглощенного фотона,
Е1 – энергия электрона в возбужденном состоянии,
Е0 - энергия электрона в основном состоянии.
D Е = h .v = h . c/ l, где
h –постоянная Планка,
v – частота излучения,
v – скорость света,
l - длина волны.
Поскольку h и c – величины постоянные, очевидно, что энергия поглощенного излучения будет обратно пропорциональна l.
Согласно хромофорно-ауксохромной теории избирательным поглощением в видимой и УФ-областях спектра обладают вещества, имеющие в своей структуре определенные группы атомов – хромофоры.
Хромофоры содержат одну или несколько кратных (двойных) связей или неподеленные пары электронов, например:
C=C – этиленовая группа,
С=О – карбонильная группа,
N=O – нитрозогруппа,
N=N – диазогруппа,
C=N – азометиновая группа,
C6H6 – бензольное ядро.
Иногда в молекуле наряду с хромофорами находятся ауксохромные группы, которые не обладают собственным поглощением, но усиливают поглощение хромофоров. К таким группам относятся:
- NH2 – аминогруппа,
- OH – гидроксильная группа,
- OCH3 – метоксигруппа,
- N(CH3)2 – диметиламиногруппа,
- Cl, Br, F, I –галогены.
Идентификацию веществ в условиях скрининга проводят по спектрам поглощения. Кривая зависимости светопоглощения от длины волны l называется спектром поглощения и является качественной характеристикой вещества.
Характер спектра может меняться в зависимости от:
- природы растворителя,
- рН раствора для веществ, способных к ионизации, если молекулярная и ионизированная формы обладают различным светопоглощением.
Получение спектров поглощения в различных условиях повышает информативность метода.
Наряду с идентификацией веществ по характеру спектра можно провести их количественное определение, измеряя интенсивность поглощения в области максимума. Расчет концентрации вещества проводят по уравнению Бугера-Ламберта-Бера:
D = Е * L * C, где
D – оптическая плотность,
Е – удельный показатель поглощения 1% раствора при толщине слоя 1 см,
L – толщина светопоглощающего слоя,
C – концентрация вещества (%).
Измерение абсорбции D проводят на спектрофотометрах различных моделей, дающих монохроматическое излучение, т.к. закон Бера справедлив только для монохроматического излучения.
При проведении скрининга сравнивают спектры поглощения исследуемого вещества со спектрами эталонов.
Достоинства спектральных методов анализа:
- универсальность, позволяющая анализировать различные классы химических соединений,
- высокая чувствительность (мкг),
- информативность.
К недостаткам метода можно отнести необходимость высокой степени чистоты исследуемых веществ, поэтому рекомендуется сочетать спектральные методы анализа с предварительной очисткой веществ, например, с помощью ТСХ или других методов.
5.3.4. Иммунохимические методы в скрининге лекарственных веществ. Иммунохимический анализ (ИХА)
Современные иммунохимические методы анализа лекарственных и наркотических средств отличаются такими особенностями, как высокая чувствительность, специфичность, экспрессность, простота выполнения. Реакция проводится непосредственно в биожидкости, поэтому не требуется применять изолирования и дополнительной очистки. Методы ИХА позволяют одновременно анализировать большое число проб, поэтому они удобны для целей экспресс-диагностики.
В то же время, широкое применение этих методов сдерживается тем, что для них требуются особые реагенты (особо чистые сыворотки, ферменты и т.п.), которые необходимо закупать у иностранных поставщиков.
В основе всех методов ИХА лежит специфическая реакция «антиген – антитело», где антигеном является определяемое вещество, чужеродное для организма. При введении в живой организм чужеродного соединения (антигена АГ) образуются антитела АТ, которые сразу связываются с антигеном. Образующийся комплекс АГ+АТ выпадает в осадок. Реакция АГ+АТ является специфичной и протекает количественно, что используется и для целей количественного определения.
Для детектирования результатов реакции один из компонентов (антиген или антитело) метят специальной меткой.
Таблица 1. Зависимость природы метки и способа ее детектирования от различных видов ИХА
| Метод | Способ детектирования |
| Радиоиммунный анализ (РИА) | Радиоактивность |
| Иммуноферментный анализ (ИФА) | Ферментная активность |
| Поляризационный флюороиммуноанализ (ПФИА) | Интенсивность флюоресцентной поляризации |
| Люминесцентный иммуноанализ (ЛИА) | Интенсивность люминесценции |
Существуют и некоторые другие методы. Наибольшее распространение в химико-токсикологическом анализе лекарственных и наркотических средств получили РИА и ИФА. В ИФА в качестве метки для антигенов (определяемых веществ) используются ферменты. Как правило, это различные оксидазы, способные окислять специальное химическое вещество – хромогенный субстрат, с образованием окрашенных продуктов. По интенсивности окраски и судят о количестве искомого вещества.
В РИА используется аналогичный принцип, только в качестве метки используется радиоактивный изотоп. Измеряя радиоактивность выделившегося изотопа, определяют количество искомого вещества.
5. 4. ВЕЩЕСТВА, ЭКСТРАГИРУЕМЫЕ ОРГАНИЧЕСКИМИ РАСТВОРИТЕЛЯМИ ИЗ КИСЛЫХ ВОДНЫХ РАСТВОРОВ
К этой группе токсических веществ относятся барбитураты, производные ксантина, отдельные алкалоиды и некоторые другие ядовитые соединения (салициловая кислота и её производные).
5.4.1. БАРБИТУРАТЫ И МЕТОДЫ ИХ ИССЛЕДОВАНИЯ
В современной медицине применяется большое число барбитуратов (производных барбитуровой кислоты). Барбитураты представляют собой одну из групп веществ, имеющих большое токсикологическое значение. Сама барбитуровая кислота (малонилмочевина) не применяется в медицине, зато широко используются ее производные.
Барбитуровая кислота может быть получена при взаимодействии мочевины и диэтилового эфира малониловой кислоты:
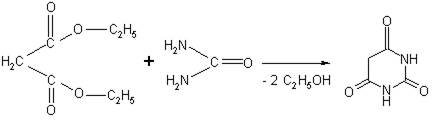
Барбитуровая кислота является циклическим уреидом и может рассматриваться как производное пиримидина (2,4,6-триоксипиримидин). Атомы водорода метиленовой группы в 5-ои положении пиримидинового цикла, а также водород, стоящий у атомов азота в 1 и 3 положениях, подвижны и способны замещаться различными органическими радикалами, атом кислорода в положении 2 также способен замещаться на атом S. На этих свойствах и основан синтез производных барбитуровой кислоты.
Общую формулу барбитуратов можно изобразить следующим образом:
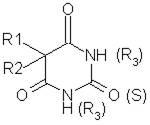
где R1, R2, R3 – радикалы, содержащие от 1 до 7 атомов углерода.
В зависимости от заместителей 1(3) и 5 положениях пиримидинового кольца, а также наличия во 2-ом положении атома О и S все барбитураты можно разделить на 3 группы:
1. 5,5-замещенные производные (двузамещенные), из которых наиболее часто применяются:
1. Барбитал R1 и R2 –C2H5
2. Фенобарбитал R1 -С2Н5 R2 -С6Н6
3. Барбамил R1 –С2Н5 R2 -СН2-СН2-СН(СН3)2
4. Этаминал-натрий R1 -С2Н5 R2 –СН-СН2-СН2-СН3
|
СН3
5. Бутобарбитал R1 С2Н5 R2 –C4H9
2. N-замещенный барбитураты (трехзамещенные):
1. Гексенал R1 –СН3 R3 –CH3 R2 – C6H5
2. Бензонал R1-CH5 R2-C6H5 R3 –CO-C6H5
3. Бензобамил R1-C2H5 R2 –CH2-CH2-CH (CH3)2
3. Тиобарбитураты (атом кислорода во 2 положении замещен на атом серы):
1. Тиопентал-натрий R1-C2H5 R2 –СН-СН2-СН2-СН3
|
СН3
СН3
По физическим свойствам все барбитураты представляют собой белые кристаллические вещества без запаха, горького вкуса, лишь тиопентал имеет желтоватый оттенок и обладает слабым запахом серы.
Кислотные (молекулярные) формы барбитуратов растворимы в эфире, хлороформе, спирте и некоторых других органических растворителях, натриевые производные – в воде.
Барбитураты имеют высокие температуры плавления, возгоняются без разложения, что используется для их очистки от посторонних примесей при выделении из биоматериала.
Химико-токсикологическое исследование барбитуратов
Этапы исследования:
1. Изолирование из объекта.
2. Очистка полученного извлечения.
3. Идентификация
4. Количественное определение
1 этап. Выбор метода изолирования определяется характером объекта и поставленными перед химиком задачами.
Для целей клинического исследования случае острых отравлений, а также в судебно-химической лаборатории, когда объектами исследования являются промывные воды желудка, диализат, небольшое количество крови и мочи, извлечение барбитуратов проводится непосредственно экстракцией органическим растворителем. В качестве экстрагентов используются эфир, хлороформ, дихлорэтан и др. Количество извлеченных барбитуратов составляет 70-90%. Однако, непосредственная экстракция, как правило, дает извлечение загрязненные соэкстрактивными веществами (жирами, белками, пигментами) и требует последующей дополнительной очистки.
При исследовании трупного материала (внутренних органов):
а) при общем (ненаправленном) судебно-химическом анализе изолирование барбитуратов проводится подкисленным спиртом и подкисленной водой. Последующая экстракция их из кислого водного раствора осуществляется органическим растворителем, чаще эфиром или хлороформом. Максимальные количества барбитуратов извлекаются в интервале рН 1-3, т.к. при данном значении рН барбитураты существуют в молекулярной форме, которая хорошо растворяется в органических растворителях и ограниченно в воде. Изолирование подкисленной водой и подкисленным спиртом обеспечивает выход барбитуратов порядка 25-30% (некоторые барбитураты изолируются этанолом на 50% - (барбамил, этаминал-Na, фенобарбитал).
б) При специальном (частном, направленном) исследовании на производные барбитуровой кислоты проводят извлечение подщелочённоё водой по методу Валова. Выход барбитуратов> 50% при достаточной чистоте выделенных веществ. Существует ряд методов, основанных на изолировании барбитуратов органическими растворителями (ацетонитрилом, ацетоном, хлороформом, смесью спирта и хлороформа) с последующей очисткой выделенных веществ.
2 этап. Очистка извлеченных барбитуратов от балластных веществ.
Как правило, барбитураты, выделенные из биологического материала, содержат примеси посторонних веществ, которые извлекаются совместно с барбитуратами и являются нормальными компонентами организма (жиры, белки, пигменты, дубильные, смолообразные вещества и др.). Соэкстрактивные (балластные) вещества мешают дальнейшей идентификации и определению барбитурата.
Выбор метода очистки зависит, в основном, от количества изолированного вещества и, до некоторой степени, от его химического строения. При больших количествах барбитуратов чаще используют экстракционный метод очистки и микросублимацию (возгонку).
Экстракционная очистка основана на способности барбитуратов к имидо-имидольной таутомерии и на различной растворимости имидной и имидольной форм в воде и органических растворителях. Используя реэкстракцию барбитурата раствором гидроксида натрия из органической фазы, тем самым освобождаются от сопутствующих веществ, нерастворимых в воде (натриевые соли хорошо растворимы воде и извлекаются ею). Последующее выделение барбитурата из водной фазы проводят после подкисления водного раствора (рН=2) экстрагированием органическим растворителем. При этом барбитурат в молекулярной форме извлекается органическим растворителем, а в водной фазе остаются балластные вещества, не растворимые в органическом растворителе.
Микросублимация основана на способности барбитуратов возгоняться без разложения при нагревании.
Возгонка проводится в нагревательной камере прибора Кофлера, либо в упрощенном виде, с одного предметного стекла на другое, верхнее из которых охлаждается, а нижнее с исследуемым остатком нагревается.
При малых количествах выделенных веществ чаще используют хроматографические методы очистки (ионообменную и гель-хроматографию на колонке, ТСХ, ВЭТСХ, ВЭЖХ).
С точки зрения простоты, доступности и разрешающей способности наибольшего внимания заслуживают ТСХ, ВЭТСХ. Они позволяют не только очистить выделенные вещества от примесей, но и разделить целый ряд барбитуратов при их совместном присутствии, а также отделить барбитураты от их метаболитов и провести предварительную идентификацию по величине Rf.
3 этап. Для идентификации барбитуратов используют химические, физические и физико-химические методы анализа.
К химическим методам можно отнести реакции окрашивания барбитуратов.
Наиболее известны следующие реакции:
1. С солями кобальта в щелочной среде. В результате реакции образуется комплекс состава Co(NH3)6OHBarb2, окрашенный в красно-фиолетовый цвет. Чувствительность реакции 30 мкг. Реакция неспецифична для барбитуратов. Её могут давать и другие соединения, по химическому строению сходные с барбитуратами (теобромин, теофиллин, биурет, некоторые сульфаниламиды).
2. С солями меди в присутствии пиридина образуется комплекс состава СuРуг2 Вагb2) красно-фиолетового цвета (тиобарбитураты - зеленого цвета).
3. С солями ртути в присутствии дифенилкарбазона (ДФК) барбитураты образуют комплексные соединения, окрашенные в сине-фиолетовый цвет. Реакция широко используется для обнаружения барбитуратов на хроматограмме Чувствительность ее достигает 0,5 мкг. Реакция неспецифична для барбитуратов.
4. Мурексидная проба (дают также пуриновые алкалоиды).
ОБЩИЕ РЕАКЦИИ НА БАРБИТУРАТЫ
1. Реакция с аммиачным раствором кобальта (П) нитрата (ацетата)
В выпарительную чашку к сухому остатку (после удаления хлороформа) прибавляют 1 каплю свежеприготовленного реактива, состоящего из 1 мл 1% спиртового раствора кобальта нитрата и 1 мл 25% раствора аммиака. Избыток реактива стряхивают в сторону и наблюдают окрашивание сухого остатка. При наличии барбитуратов появляется розово–фиолетовое окрашивание.

Открываемый минимум реакции 5 мг.
2. Мурексидная проба
В фарфоровую чашку к сухому остатку прибавляют 3 капли 3% раствора водорода пероксида и 3 капли реактива, содержащего соль Мора и аммония хлорид. Содержимое чашки выпаривают и нагревают сухой остаток до появления белых паров. После охлаждения прибавляют 3 капли 6 М раствора аммония гидроксида. При наличии некоторых барбитуратов и тиобарбитуратов появляется розовая окраска.
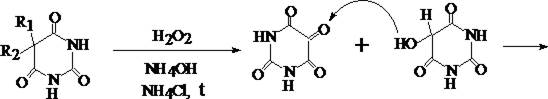
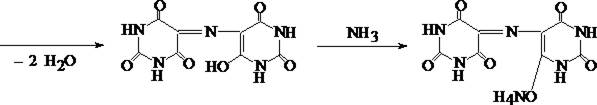
Мурексид
Открываемый минимум реакции различен для каждого из барбитуратов. В среднем 3 – 5 мг. Эту реакцию дают также производные пурина.
3. Реакция образования железистой соли изонитробарбитуровой кислоты
Остаток после удаления органического растворителя в фарфоровой чашке смешивают с 0,04 г аммония хлорида в 10 мл водорода пероксида. Полученный раствор выпаривают досуха на водяной бане, изредка перемешивая. Не снимая чашки с водяной бани, остаток растворяют в 1 – 2 мл воды очищенной и смешивают до получения жидкости желтоватого цвета с 4 – 6 каплями реактива. Нагревают около 30 сек на кипящей водяной бане, добавляют 0,1 г кристаллического натрия нитрита и по каплям 7% раствор хлороводородной кислоты до рН = 3 – 4. При нагревании в течение 3 мин возникает пурпурная или розовая окраска. Чашку снимают и по охлаждении добавляют по каплям 5% раствор натрия гидроксида до слабощелочной реакции, фильтруют, вносят кристаллик железа (II) сульфата – появляется синее окрашивание.
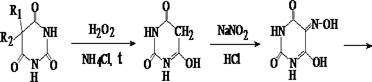
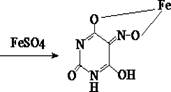
Открываемый минимум 50 мг.
Микрокристаллические реакции
В микрокристаллоскопическом анализе барбитуратов использована их способность образовывать характерные кристаллические осадки при взаимодействии с солями тяжелых металлов (хлорцинкйодом, железо- и медно-йодидным комплексами, медно-пиридиновым реактивом) и выпадать в осадок из растворов концентрированной серной кислоты при понижении ее концентрации (выделение кислотной формы барбитурата).
Формы образующихся кристаллов характерны для каждого отдельного барбитурата. Чувствительность реакции достигает мкг и даже десятых долей мкг.
Обладая высокой чувствительностью, доказательностью и специфичностью, микрокристаллические реакции не лишены и ряда недостатков:
- их проведение требует высокой степени чистоты исследуемого вещества, наличие примесей снижает чувствительность реакции, а также мешает правильной кристаллизации.
-производные барбитуровой кислоты склонны к полиморфизму образующихся кристаллов. В зависимости от ряда факторов - концентрации вещества, скорости кристаллизации, температуры, наличия посторонних примесей - барбитураты способны образовывать кристаллы различной формы, что затрудняет идентификацию отдельных веществ по форме кристаллов.
1. Выделение кислотной формы барбитуратов
На предметное стекло наслаивают несколько капель хлороформного раствора исследуемого вещества, удаляя хлороформ при комнатной температуре. Следующую каплю наносят после испарения предыдущей. Сухой остаток растворяют в капле концентрированной серной кислоты. Через 3 – 5 мин после охлаждения раствора рядом с ним наносят каплю воды. Затем эти капли соединяют при помощи капилляра. Через 10 – 20 мин (а при малых количествах барбитуратов через 1 – 2 ч) появляются кристаллические осадки. Для каждого барбитурата кристаллы кислотной формы отличаются по внешнему виду.
2. Реакция с хлорцинкиодидом
На предметное стекло наносят несколько капель хлороформного раствора исследуемого вещества и выпаривают досуха. К сухому остатку прибавляют 1 каплю 96 % этанола и каплю раствора хлорцинкиодида. Через 10 – 15 мин под микроскопом наблюдают форму образовавшихся кристаллов.
Открываемый минимум 4 мг.
3. Реакция с железойодидным комплексом
К сухому остатку (после удаления хлороформа) прибавляют 1 каплю 96% этанола и 1 каплю реактива. Через 10 – 15 мин под микроскопом наблюдают форму образовавшихся кристаллов.
4. Реакция с меднойодидным комплексом
К сухому остатку исследуемого вещества на предметном стекле добавляют 1 каплю 96% этанола и каплю медноиодидного комплекса. Через 10 – 15 мин наблюдают образование кристаллических осадков.
Открываемый минимум 0,6 мг.
5. Реакция со спиртовым раствором калия йодида
К сухому остатку на предметном стекле добавляют 1 каплю спиртового раствора калия йодида в присутствии серной кислоты, через 5 – 10 мин образуются хорошо оформленные кристаллические осадки.
Открываемый минимум 0,5 мг.
6. Реакция с меднопиридиновым реактивом
К сухому остатку на предметном стекле прибавляют 2 каплю 10% раствора аммиака и 1 – 2 капли меднопиридинового реактива. Через 10 – 15 мин наблюдают под микроскопом характерные сростки кристаллов бледно–фиолетового цвета.
Открываемый минимум 13,7 мг.
7. Реакция с родамином 6 Ж
В делительную воронку вносят 0,1 мл раствора исследуемого вещества, прибавляют 0,2 мл 0,1% раствора родамина 6 Ж и 1 мл четыреххлористого углерода. Смесь взбалтывают в течение 1 мин. При наличии солей барбитуратов слой четыреххлористого углерода приобретает светло–оранжевую или оранжево–красную окраску. При взаимодействии образуются окрашенные ионные ассоциаты, которые экстрагируются четыреххлористым углеродом.
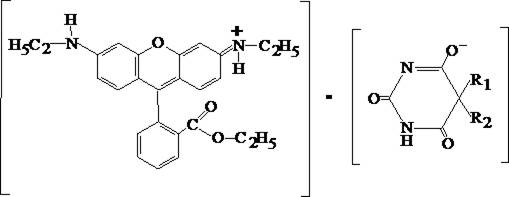
Таблица 2. Физические свойства барбитуратов и хромогенные реакции на функциональные группы
| Барбитураты | Растворимость | Другие частные реакции, применяемые для исследования остатков таблеток, порошков и др. т.п. | |||
| Вода | Орг. раст. | Щел. среда | H2SO4 конц. | ||
Барбамил
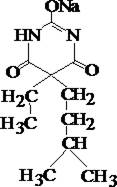
| + | ¾ | + | + | При нагревании водного раствора с 20% раствором п-диметиламинобензальдегида в концентрированной серной кислоте, появляется стойкое тёмно–красное окрашивание с зелёной флюоресценцией. |
Барбитал
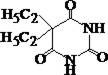
| ¾ | + | + | + | |
Этаминал–натрий
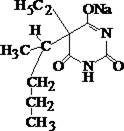
| + | ¾ | + | + | Реакции: а) с родамином 6Ж; б) с п-диметиламинобензальде-гидом в концентрированной серной кислоте (см. барбамил). |
Бензонал
| ¾ | + | + | + | Реакция образования азокрасителя (см. фенобарбитал). |
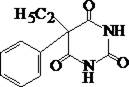
Фенобарбитал

| ¾ | + | + | + | Небольшое количество вещества растворяют в 3 мл концентрированной серной кислоты. К этому раствору прибавляют 0,5 г калия нитрата и нагревают 10 мин на кипящей водяной бане, затем охлаждают и прибавляют 10 мл воды, при наличии осадка его отфильтровывают и перекристаллизовывают из этанола. Нитрогруппу восстанавливают в аминогруппу, а затем обнаруживают при помощи реакции диазотирования и получения азокрасителя. Реакция специфична, но малочувствительна. |
Гексенал
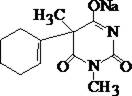
| + | ¾ | + | + | Реакции: а) нагревание с реактивом Марки, появляется светло–коричневое флюоресцирующее окрашивание; б) нагревание с ванилин–серной кислотой, появляется вишнёво–красное окрашивание; г) нагревание со спиртовым раствором ванилина, 2 мл разв. Н2SO4 и 10 мл воды очищенной, наблюдается фиолетово–красное окрашивание. |
Из физических и физико-химических методов анализа применение нашли ТСХ ВЭТСХ, ВЭЖХ, спектроскопия в УФ и ИК o6ластях спектра.
Хроматография в тонком слое используется в качестве предварительного испытания на наличие производных барбитуровой кислоты. Они дают возможность разделить несколько 6aрбитуратов при их совместном присутствии и идентифицировать каждый барбитурат в случае комбинированного отравления. ТСХ позволяет также отделить барбитураты от их метаболитов и провести очистку полученного извлечения от балластных веществ. Хроматографирование ведут на пластинках с закрепленным слоем силикагеля в системах растворителей:
1) хлороформ-ацетон (9:1) - для разделения N - замещенных и 5 5-замещенных производных, система является общей в скрининге лекарственных веществ кислого и нейтрального характера.
2) толуол - ацетон - этанол - 25% раствор аммиака (45:45:7,5:2,5) (применяется в экспресс- анализе интоксикаций)
3) хлороформ - н-бутанол - 25% раствор аммиака (70:40:5) - в качестве частной системы для разделения 5,5 -замещенных барбитуратов.
Детектирование веществ на хроматограмме проводится двумя реагентами: дифенилкарбазоном (ДФК) и HgS04. При этом в местах расположения барбитуратов возникают красно- или сине-фиолетовые пятна. Идентификация проводится по величине Rf (отношение длины пробега вещества к длине пробега растворителя). Хроматографирование ведут параллельно метчикам (А), в качестве которых используют хлороформные растворы барбитуратов с известной концентрацией.
Дата добавления: 2015-08-01; просмотров: 3037;
