ГРУППА ВЕЩЕСТВ, ИЗОЛИРУЕМЫХ ИЗ БИОЛОГИЧЕСКОГО МАТЕРИАЛА ЭКСТРАКЦИЕЙ И СОРБЦИЕЙ 4 страница
Применение метчиков наряду с расчетом Rf обусловлено невоспроизводимостью Rf из-за трудности соблюдения стандартных условий при хроматографировании. Чувствительность реакции барбитуратов с ДФК и HgSО4 достигает 0,5 мкг, однако, она неспецифична, поэтому дальнейшее подтверждение присутствия барбитурата производится микрокристаллическими реакциями, исследованием в УФ-области спектра после элюирования вещества с пластинки подходящим растворителем (боратный буфер с рН=10).
Спектроскопическое исследование барбитуратов чаще проводят в области длин волн 200-400 нм, т.е. в УФ-области спектра, получая электронные спектры поглощения (что обусловлено наличием в структуре системы хромофоров и ауксохромов). Способность барбитуратов к абсорбции в УФ-области связана с их таутомерными превращениями.
Для 5,5-замещенных производных:
1. Имидная форма (рН 2) не абсорбирует в УФ области, т.к. здесь отсутствует хромофорная система (система сопряженных простых и двойных связей).
2. Имидольная форма (рН 10) уже имеет такую систему и обладает характерным поглощением с mах=240 нм.
3. Диимидольная форма также обладает характерным поглощением с mах=255-260 нм. Здесь происходит удлинение хромофорной системы за счет образования еще одной двойной связи и, соответственно этому батохромный сдвиг максимума (в длинноволновую область).
В отличие от 5,5-двузамещенных барбитуратов, трехзамещенные имеют лишь одну ионизированную форму (имидольную), поэтому их поглощение не меняется с переходом от рН 10 к рН 13, и они обладают одним максимумом в щелочной среде при длине волны 245 нм.
Таким образом, УФ-спектроскопия дает возможность дифференцировать барбитураты в зависимости от типа замещения в пиримидиновом кольце на:
1. Двузамещенные (рН 2 - нет max, рН 10 - 240 нм, рН 13 -255-260 нм).
2. Трехзамещенные (рН 2 - нет max, рН 10 и рН 13 -245 нм).
3. Тиобарбитураты (рН 2 - 239 нм и 290 нм, рН 10 - 255 и 310 нм, рН 13 – 310 нм).
Однако, дифференциация отдельных представителей внутри каждого из типов замещения затруднительна, т.к. их спектры сходны между собой.
Применение спектральных методов анализа требует высокой степени чистоты выделенных веществ и должно сочетаться с их хроматографической очисткой.
Заключение о присутствии барбитуратов дается по комплексу результатов реакций, ХТС и УФ-спектроскопии.
4 этап. Для количественного определения барбитуратов в настоящее время используется спектрофотометрический метод. При спектрофотометрическом определении барбитуратов, выделенных из биологического материала, используют принцип дифференциальной спектрофотомерии, т.к. прямому СФ-определению мешают посторонние вещества, извлекающиеся из объекта исследования совместно с барбитуратами.
В I варианте концентрацию барбитурата в растворе (после его элюирования с пластинки) определяют по разности абсорбции в щелочном - рН 10 и кислом - рН 2 растворах при l=240 нм.
DD=DрH10-DpH2
Во II варианте - по разности абсорбции в щелочных рН 13 и рН 10 растворах при l=260нм.
DD=DpH13-DpH10|
Использование принципа дифференциальной спектрофотомерии возможно, когда поглощение примесей при выбранной длине волны не зависит от рН среды. Тогда при вычитании оптических плотностей происходит уничтожение абсорбции примесей, что дает возможность получать истинные результаты количественного определения.
Расчет концентрации ведут по уравнению закона Бугера-Ламберта-Бера:
DD = Е1% * L *С, откуда С = DD /E 1% * L, где
С - концентрация вещества в %;
DD - дифференциальная оптическая плотность (абсорбция);
Е1% - удельный показатель поглощения (численно равен поглощению 1% раствора при толщине слоя 1 см). Рассчитывается заранее для каждого барбитурата по растворам с известной концентрацией.
L- толщина светопоглощающего слоя (1 см)
С точки зрения чувствительности определения наиболее выгодным оказывается 1 вариант, т.к. он дает большую DD. Однако, в коротковолновой области при l=240 нм сильнее проявляется мешающее влияние примесей, поэтому чаще этот вариант используют в сочетании с предварительной хроматографической очисткой.
Во 2 варианте DD несколько меньше, в связи с чем ниже и чувствительность определения, но одновременно снижается влияние примесей в более длинноволновой области при 260 нм. Поэтому увеличивается надежность определения. Этим вариантом можно пользоваться даже без предварительной хроматографической очистки, например, при работе с биологическими жидкостями (кровь, моча), не подвергшимися гнилостному разложению.
Определение концентрации барбитуратов в биологических жидкостях позволяет:
а) установить тяжесть отравления и контролировать эффективность проводимого лечения в условиях клиники при острых отравлениях барбитуратами,
б) в посмертных случаях позволяет сделать заключение о приеме токсических или терапевтических доз, т.е. ответить на вопрос - явилось ли найденное вещество причиной смерти.
Токсические уровни барбитуратов в крови обычно превышают десятки мкг/мл, а при тяжелых отравлениях, заканчивающихся смертельным исходом, - сотни мкг/мл.
Токсикологическое значение барбитуратов обусловлено, с одной стороны, их сильным фармакологическим действием (список Б, барбамил и этаминал - список А), а с другой стороны - сравнительной доступностью для населения.
Опасность отравления усиливается способностью барбитуратов к кумуляции, т.е. накоплению в организме даже при приеме терапевтических доз. В настоящее время известно о возможном пристрастии к этой группе препаратов и о синергизме при совместном приеме с алкоголем, опиатами и психотропными средствами (транквилизаторами, алкалоидами белладонны и др.), что усиливает токсикологическое значение барбитуратов.
Токсичность. Смертельной дозой барбитуратов считают одномоментный прием 10 разовых доз каждого из препаратов или их смеси с различными индивидуальными различиями (фенобарбитал -2,0, этаминал-Na -1,0). Иногда же эта доза достигает 4 и даже 6-10 г (барбитал).
Токсикокинетика барбитуратов
(всасывание, распределение, метаболизм, выделение)
Всасывание. Все барбитураты, являясь слабыми кислотами (рКа=7,2-3,0), при физиологическом значении рН легко всасываются в желудке и тонком кишечнике способом пассивной диффузии. Этот процесс значительно ускоряется в присутствии алкоголя. Наибольшие концентрации в плазме достигаются для барбитала через 4-8 часов, фенобарбитала - 12-18 часов. Ослабление перистальтики кишечника в глубоком коматозном состоянии может задержать пребывание барбитуратов в желудке до нескольких суток.
Распределение. Барбитураты распределяются по тканям и биологическим жидкостям организма, однако концентрация их может быть различной в зависимости от нескольких факторов:
1. Степени ионизации молекул (при физиологическом значении рН).
2. Жирорастворимости (липофильности)-N-замещенные более липофильны.
3. Степени связывания с белками.
4. Интенсивности кровотока и др.
Связь барбитуратов с белками плазмы в количественном отношении:
барбамил - 50-60%,
этаминал-натрий -50-55%
фенобарбитал - 15%
барбитал -5%
Свободная фракция барбитуратов, в основном, определяет физиологическую активность препарата. Чем меньше связь барбитуратов с белками плазмы, тем в большей степени они выделяются с мочой в неизменённом виде. Наибольшие концентрации барбитуратов определяются в печени, почках селезенке, крови и тканях мозга.
Метаболизм. В организме барбитураты могут подвергаться ряду превращений. Выделяются 4 основных типа превращений:
- Окисление радикалов в 5-ом положении до спиртов, кислот и кетонов (введение группы -ОН вместо Н в метиленовой группе, присоединение -ОН к фенильному радикалу, окисление конечной -СН3 группы до карбоксильной группы)
2. Потеря радикала у атома N в случае 3-х замещенных производных и превращение их в дизамещенные производные:
а) деметилирование гексенала

б) дебензоилирование бензонал и бензобамил и превращение их в фенобарбитал и кислотную форму барбамила соответственно

- Десульфирование тиобарбитуратов

- Гидролиз (распад пиримидинового кольца)
Выделение.
Наиболее устойчивым из барбитуратов является барбитал, который на 65-85% выводится в неизменённом (нативном) состоянии с мочой. Барбамил, этаминал-Na, бутобарбитал почти полностью разрушаются в печени и выводится почками лишь в виде следов (10%). Гексенал и тиопентал полностью разрушаются в печени (при введении терапевтических доз) и выводятся в виде метаболитов.
Повторное поступление барбитуратов в организм вызывает развитие толерантности к ним; что зависит от стимуляции активности микросомальных ферментов печени и снижения чувствительности со стороны ЦНС.
Токсикодинамика (развитие отравлений)
Барбитураты принадлежат к обширной группе лекарственных препаратов снотворного действия, которые обладают способностью избирательного токсического действия на ЦНС, что приводит к угнетению всех ее основных функций. В клинической картине острых отравлений барбитуратами и другими снотворными и седативными средствами выделяют 4 ведущих клинических синдрома:
1. Коматозное состояние и другие неврологические расстройства (оглушённость, сон, отсутствие рефлексов).
2. Нарушение дыхания.
3. Нарушение функции сердечно-сосудистой системы.
4. Трофические расстройства и нарушение функций почек (соматогенная фаза отравления).
(1 - 3 симптомы соответствуют токсикогенной фазе отравления)
1 синдром: для коматозного состояния, вызванного угнетающим действием барбитуратов на ЦНС, характерна определенная стадийность, когда последовательно развиваются явления:
1. Оглушения и глубокого сна -1 стадия комы.
2. Поверхностная кома с повышением или снижением сухожильных рефлексов и реакций зрачков на свет -2 стадия комы.
3. Глубокая кома с арефлексией (отсутствие рефлексов} и отсутствием реакции на болевое раздражение - 3 стадия комы.
Глубокая кома сопровождается нарушением дыхания и кровообращения. Определение содержания барбитуратов в крови методом спектрофотомерии позволяет отметить определенную зависимость развития коматозного состояния от уровня этих препаратов в крови. Так, поверхностная кома наблюдается при содержании
Этаминала-натрия 0,1 г/л (100 мкг/мл)
Барбамила 0,3 г/л (300 мкг/мл)
Фенобарбитала > 0,4 г/л (400 мкг/мл)
Концентрация барбитуратов в спинномозговой жидкости примерно соответствует содержанию их в крови, а в моче значительно выше, но не зависит от глубины коматозного состояния.
Таким образом, количественное определение барбитуратов значительно облегчает дифференциальную диагностику отравлений при коме неясной этиологии.
2 синдром: нарушения внешнего дыхания являются наиболее частыми и грозными осложнениями коматозных состояний. Они отмечаются у 11% больных с данной патологией и требуют незамедлительной дыхательной реанимации (бронхорея - слизь в бронхах, гиперсаливация - усиленное слюноотделение, западение языка, ларингоспазм или аспирация (вдыхание) промывной жидкости - аспирационно-обтурационная форма нарушения внешнего дыхания). Центральная форма - как прямое угнетение центров продолговатого мозга (дыхательного центра) снотворными средствами. После ликвидации острых нарушений внешнего дыхания основной причиной дыхательной недостаточности становятся воспалительные процессы в легких - пневмонии и трахеобронхиты.
3 синдром: основными клиническими симптомами нарушения функций сердечно-сосудистой системы при данной патологии служат явления тахикардии и гипотонии.
4 синдром: заметное место в клинической симптоматике отравлении снотворными занимают трофические расстройства. Они отмечаются в виде буллезного дерматита и некротического дерматомиозита, протекающего по типу быстро развивающихся пролежней, что указывает на местное расстройство кровообращения. Возникновение нарушений функции почек при данной патологии, в основном, связано с развитием острой сердечной недостаточности (коллапсом).
Смерть при отравлении барбитуратами наступает от паралича дыхательного и сосудодвигательного центров. При смертельных исходах после отравления барбитуратами картина вскрытия нехарактерна, поэтому химико-токсикологическое исследование внутренних органов (особенно печени и мозга), крови и мочи приобретают особое значение.
Данные о сохраняемости барбитуратов в трупном материале разноречивы: от нескольких дней до нескольких лет (1-3 года), что зависит от химического строения барбитурата и условий хранения биоматериала.
5.4.2. КИСЛОТА САЛИЦИЛОВАЯ
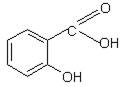
о-оксибензойная кислота
Реакции обнаружения:
1. Реакция образования трибромфенола
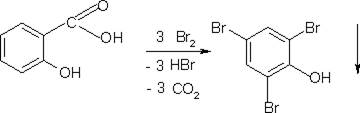
К остатку после удаления растворителя в фарфоровой чашке добавляют 1-2 кап. воды очищенной и 1 кап. этанола, жидкость перемешивают и добавляют 2-3 кап. насыщенного раствора бромной воды.
При наличии кислоты салициловой образуется белый осадок.
Реакция высокочувствительна, но неспецифична и имеет отрицательное судебно-химическое значение.
2. Реакция с железа (III) хлоридом
а) К остатку после удаления растворителя в фарфоровой чашке добавляют 1 кап. свежеприготовленного раствора железа (III) хлорида Появляется сине-фиолетовое окрашивание, не исчезающее от добавления 2-3 кап. этанола.
б) На фильтровальную бумагу помещают 1 капли свежеприготовленного раствора железа (III) хлорида и подсушивают. Затем на то же место наносят 1-2 капли исследуемого извлечения - тотчас появляется сине-фиолетовое окрашивание.
3. Реакция образования метилсалицилата
СН3ОН + HOSО3H → CH3OSО3H + Н2О
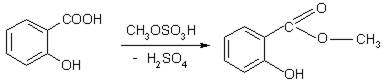
В пробирку помещают несколько капель исследуемого раствора, растворитель удаляют при слабом нагревании на водяной бане, к остатку добавляют 2-3 кап. конц. серной кислоты., 2-3 кап. метанола и нагревают на водяной бане. Появляется характерный запах метилового эфира кислоты салициловой.
4. Реакция образования ауринового красителя
Часть сухого остатка помещают в чашку и сверху наносят 1 каплю реактива Марки. При наличии салициловой кислоты наблюдают красное окрашивание.
Реакция неспецифична.
ПРОИЗВОДНЫЕ ПИРАЗОЛОНА
5.4.3. АНТИПИРИН

Белый кристаллический порошок, слабо горького вкуса, без запаха, хорошо растворяется в воде, спирте, хлороформе, хуже в эфире. Экстрагируется органическим растворителем из кислых растворов.
Реакции обнаружения
1. Реакция с железа (III) хлоридом
К сухому остатку в фарфоровой чашке прибавляют 1 каплю 5% железа (III) хлорида. При наличии антипирина появляется кроваво–красная или оранжево–красная окраска.
Реакция неспецифична.

ферропирин
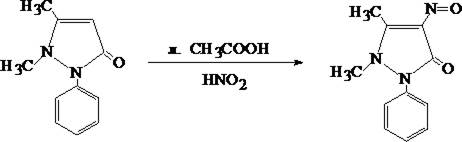
2. Реакция образования нитрозоантипирина
Сухой остаток растворяют в 3 –5 каплях воды очищенной, прибавляют 2 – 4 капли 10% раствора серной кислоты и 2 – 3 капли насыщенного раствора натрия нитрита. При наличии антипирина появляется зелёная окраска; при больших количествах может выпасть зелёный осадок.
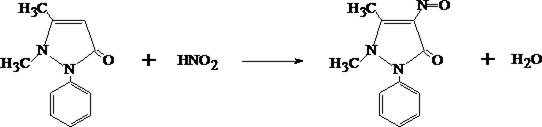
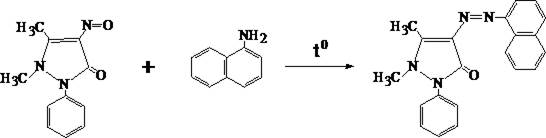
3. Реакция образования азокрасителя
В пробирку вносят 2 – 5 капель хлороформной вытяжки, которую выпаривают досуха на водяной бане. К сухому остатку прибавляют 1 –2 капли воды, 1 каплю ледяной уксусной кислоты и каплю 5% раствора натрия нитрита. Смесь оставляют на 5 мин при периодическом взбалтывании. Затем добавляют небольшое количество мочевины. После прекращения выделения пузырьков газа прибавляют 3 – 4 кристаллика a–нафтиламина и нагревают пробирку на водяной бане 1 – 2 мин. В зависимости от количества антипирина появляется тёмно– или светло–фиолетовая окраска.
изб. HNO3 +  ® 2 N2 + CO2 + H2О
® 2 N2 + CO2 + H2О
Реакция чувствительна и специфична.
С помощью данной реакции можно отличить антипирин от амидопирина.
4. Микрокристаллическая реакция с солью Рейнеке
К сухому остатку на предметном стекле добавляют каплю воды и каплю реактива. Через 3 – 5 мин. начинается кристаллизация. Кристаллы в форме дендритов и сростков из призм (см. альбом «микрокристаллоскопические реакции»).
5.4.4. АМИДОПИРИН
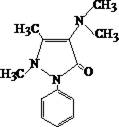
Белый кристаллический порошок, слабо горького вкуса, без запаха, хорошо растворяется в воде, спирте, хлороформе. Экстрагируется из кислых и щелочных растворов.
Реакции обнаружения
При действии на амидопирин окислителей образуется ряд окрашенных промежуточных продуктов. При дальнейшем окислении этих продуктов образуется диоксиамидопирин (бесцветные кристаллы):

1. Реакция с железа (III) хлоридом
На предметное стекло наносят раствор исследуемого вещества и выпаривают досуха, а затем прибавляют каплю 1% железа (III) хлорида, появляется фиолетовая окраска, исчезающая от избытка реактива.
2. Реакция с серебра нитратом
В пробирку вносят 2 – 3 капли водного раствора исследуемого вещества, прибавляют 3 – 5 капель 1% раствора серебра нитрата и нагревают на водяной бане в течение 3 – 5 мин. Появление фиолетовой окраски указывает на наличие амидопирина в растворе. При больших количествах амидопирина может выпасть чёрный осадок металлического серебра.
3. Реакция с кислотой азотистой
На предметное стекло наносят несколько капель раствора исследуемого вещества и выпаривают досуха. К остатку прибавляют 1 каплю воды, 1 каплю 10% раствора серной кислоты и несколько капель насыщенного раствора натрия нитрита. При наличии амидопирина появляется фиолетовая окраска, исчезающая от избытка реактива.
Если присутствует и антипирин, то вначале появляется фиолетовая окраска (амидопирин), а под влиянием избытка реактива фиолетовая окраска исчезает, а появляется зелёная (антипирин).
4. Реакция с раствором йода в хлороводородной кислоте
К остатку амидопирина на предметном стекле прибавляют 1 – 2 капли раствора йода в концентрированной хлороводородной кислоте – выделяется через некоторое время осадок в виде призматических кристаллов.
5. Микрокристаллическая реакция с аммония тетрароданодиаминохромиатом (Ш) (солью Рейнеке)
Несколько капель хлороформного раствора испаряют на предметном стекле. Полученный осадок растворяют в капле воды, а затем прибавляют каплю реактива. При наличии амидопирина тотчас начинается кристаллизация. Форма кристаллов – сферолиты и сростки из розовых призм (см. альбом «микрокристаллоскопические реакции»).
ПРОИЗВОДНЫЕ КСАНТИНА
5.4.5. КОФЕИН
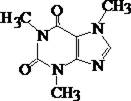
Кофеин является алкалоидом, который содержится в кофе, чае и некоторых других растениях. Экстрагируется органическими растворителями из кислых и частично из щелочных растворов.
Реакции обнаружения
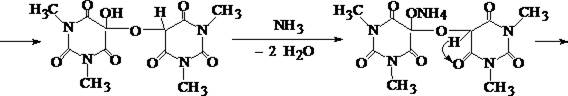
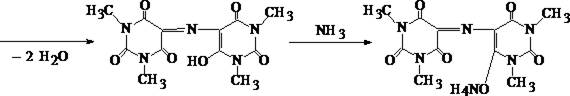
1. Мурексидная реакция
5 – 6 капель хлороформного раствора исследуемого вещества помещают в фарфоровую чашечку, и растворитель испаряют без нагревания. К сухому остатку прибавляют 0,5 – 1 мл насыщенного раствора бромной воды и выпаривают на водяной бане досуха. К окрашенному в буроватый цвет остатку подносят на стеклянной палочке 1 каплю 25% раствора аммиака. Остаток в чашке при наличии кофеина приобретает пурпурно–фиолетовое окрашивание.
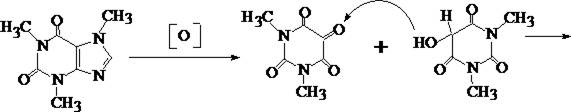
диметилаллоксан диметилдиалуровая кислота
2. Кофеин даёт осадки с реактивами Драгендорфа, Зонненшейна, Шейблера и др.
3. Реакция с реактивом Несслера
При нагревании раствора с реактивом Несслера (на кипящей водяной бане) в течение 1 – 2 мин появляется красно–бурый осадок.
4. Реакция с ртути (II) хлоридом
На предметное стекло наслаивают 2 – 3 капли исследуемого хлороформного раствора. На сухой остаток после удаления хлороформа наносят каплю 0,1 моль/л раствора хлороводородной кислоты и каплю 5% раствора ртути (II) хлорида, через 10 – 15 мин образуются крупные, шелковистые, бесцветные иглообразные кристаллы.
Открываемый минимум 9,4 мкг.
5.4.6. ТЕОБРОМИН
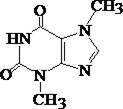
Алкалоид пуринового ряда, содержится в бобах какао, некоторое количество содержится в чае. Трудно растворяется в воде, спирте, эфире, хлороформе. Экстрагируется органическими растворителями из кислых и частично из щелочных растворов.
Реакции обнаружения
1. Мурексидная реакция
(См. кофеин)
2. Реакция с реактивом Несслера
(См. кофеин) В отличие от кофеина появляется слабо–коричневая окраска.
3. Реакция с аммиачным раствором кобальта (П) нитрата
(См. обнаружение барбитуратов). Реакция используется для отличия от кофеина.
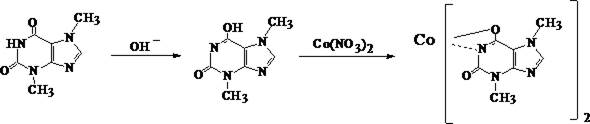
4. Микрокристаллическая реакция с реактивом Драгендорфа
Раствор исследуемого вещества в хлороформе наносят на предметное стекло и при комнатной температуре выпаривают досуха. К сухому остатку прибавляют каплю 10% раствора хлороводородной кислоты и каплю реактива Драгендорфа. Через 10 – 15 мин появляются тёмно–красные игольчатые кристаллы, собранные в пучки. Параллельно проводят реакцию с фармакопейным препаратом.
Открываемый минимум 19 мкг.
Кофеин в таких же условиях даёт более мелкие кристаллы.
5.4.7. ТЕОФИЛЛИН
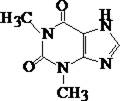
Алкалоид пуринового ряда, по химическому строению является изомером теобромина. Небольшое количество содержится в листьях чая. Экстрагируется органическими растворителями из кислых и частично из щелочных растворов.
Реакции обнаружения
1. Мурексидная реакция
(См. кофеин).
2. Реакция с диазотированной сульфаниловой кислотой
Продукт реакции:
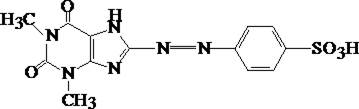
Теобромин не дает этой реакции!
3. Реакция с аммиачным раствором кобальта (П)нитрата
(Методику см. обнаружение барбитуратов). Реакция используется для отличия от кофеина.
5.5. АЛКАЛОИДЫ
Из веществ, экстрагируемых органическим растворителем из щелочного раствора, наибольшее токсикологическое значение имеют алкалоиды.
Алкалоиды - органические азотистые основания сложного состава, встречающиеся в растениях (реже в животных организмах) и обладающие сильным фармакологическим действием.
Токсикологическое значение алкалоидов
Токсикологическое значение алкалоидов очень велико и связано со следующими факторами:
1. Алкалоиды обладают высокой токсичностью, но в то же время широко применяются в медицинской практике в качестве лекарственных веществ. Медицинское применение алкалоидов очень разнообразно, т.к. каждый из них обладает своим специфическим действием, иногда очень ценным и незаменимым.
Как лекарственные препараты алкалоиды проявляют фармакологический эффект в очень малых дозах. С другой стороны, алкалоиды обладают выраженной токсичностью и при превышении терапевтических доз могут являться причиной отравлений и даже смерти.
2. Некоторые алкалоиды применяются в сельском хозяйстве в качестве инсектицидов (никотин, анабазин). Их токсичность и доступность может также привести к отравлениям.
3. Наконец, широкое распространение алкалоидсодержащих растений (многие из них растут как сорняки), их доступность приводят к тому, что при поедании частей растений, содержащих алкалоиды, детьми или домашними животными, наблюдаются отравления различной степени тяжести, нередко со смертельным исходом. Известны отравления ягодами белладонны, плодами белены, дурмана, паслена сладко-горького, болиголова и других алкалоидсодержащих растений.
Отравления отдельными алкалоидами могут давать характерную картину: судороги при отравлении стрихнином, расширение зрачков при отравлении тропановыми алкалоидами. Однако, чаще всего картина отравления и, тем более, патологоанатомического исследования, нехарактерны. Поэтому главное значение при доказательстве отравлений алкалоидами приобретает химико-токсикологическое (судебно-химическое) исследование. При отравлении растениями большую помощь может оказать фармакогностическое исследование частей растений в содержимом желудка.
В зависимости от химического строения алкалоиды, имеющие токсикологическое значение, можно разделить на 10 групп:
- Производные пиридина, пиперидина и хинолизидина (жидкие алкалоиды):
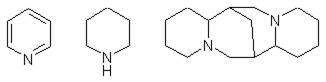
а) моноциклические (конин, ареколин)
б) бициклические (анабазин, никотин)
в) полициклические (пахикарпин)
- Производные тропана (пиперидил-пирролидина)
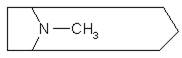
атропин, гиосциамин, скополамин, кокаин
- Производные хинолина (бензопиридина)
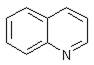
хинин
- Производные изохинолина (бензопиридина)-группа опийных алкалоидов
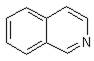
а) производные фенантренизохинолина (морфин, кодеин, дионин, апоморфин, героин)
б) производные бензилизохинолина (папаверин, наркотин)
Дата добавления: 2015-08-01; просмотров: 2869;
