ГРУППА ВЕЩЕСТВ, ИЗОЛИРУЕМЫХ ИЗ БИОЛОГИЧЕСКОГО МАТЕРИАЛА ЭКСТРАКЦИЕЙ И СОРБЦИЕЙ 5 страница
- Производные индола (бензопиррола)
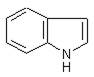
стрихнин, бруцин, резерпин
- Производные пурина
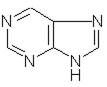
кофеин, теобромин, теофиллин
- Производные 1-метилпирролизидина
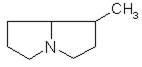
саррацин, платифиллин
- Ациклические алкалоиды
9. Алкалоиды стероидоподобного строения (вератрин)
10. Алкалоиды неустановленного строения (аконитин)
Из перечисленных групп алкалоидов, согласно приказа № 1021 от 25.12.73 Министерства здравоохранения СССР, при проведении общего судебно-химического анализа обязательному исследованию подлежат: алкалоиды - никотин, пахикарпин; тропановые алкалоиды; производные изохинолина (опийные алкалоиды); производные индола - стрихнин.
Физико-химические свойства алкалоидов, которые имеют значение в химико-токсикологическом анализе.
1. Большинство алкалоидов - твердые кристаллические, реже аморфные вещества без запаха, горького вкуса. Исключение составляют жидкие алкалоиды кониин, ареколин, никотин, анабазин, пахикарпин, основания которых являются летучими маслянистыми жидкостями, обладающими характерным запахом.
2 Растворимость алкалоидов-оснований и их солей различна. Основания алкалоидов практически нерастворимы в воде и легко растворяются в органических растворителях - эфире, хлороформе, этаноле, дихлорэтане и др.
Наоборот, соли алкалоидов легко растворимы в воде и спирте, но, как правило, нерастворимы в органических растворителях.
Однако, алкалоиды-жидкости составляют исключение, их основания растворяются и в воде, и в органических растворителях, что приходится учитывать при проведении судебно-химического исследования на наличие алкалоидов.
Соли некоторых алкалоидов, например, хлористоводородные соли кокаина, наркотина, папаверина, йодистоводородная соль пахикарпина способны растворяться в хлороформе.
Алкалоиды с малой величиной константы диссоциации (КД=10-14 – 10-12 ) кофеин, теобромин, теофиллин, папаверин, стрихнин и бруцин - дают непрочные соли, гидролизующиеся даже в кислой среде, поэтому способны экстрагироваться из кислого водного раствора.
3. За счет гетероатома азота (третичного), содержащегося в молекуле, алкалоиды:
а) обладают основными свойствами и дают соли с кислотами аммиака и аминов).
б) вступают во взаимодействие с солями тяжелых металлов, с некоторыми кислотами с образованием нерастворимых осадков (реакции с общеалкалоидными реактивами и микрокристаллоскопические реакции).
4. Некоторые алкалоиды способны давать окрашенные соединения с кислотами за счет дегидратации. Окрашенные продукты могут получаться при окислительно-восстановительных реакциях алкалоидов, при реакциях конденсации.
5. Большинство алкалоидов, имеющих хромофорную систему, обладает характерным светопоглощением в УФ области спектра.
6. Алкалоиды имеют характерное светопоглощение в ИК - области спектра.
Химико-токсикологическое исследование на алкалоиды складывается из ряда этапов:
1. Изолирование алкалоидов из биологического объекта.
2. Очистка полученного извлечения от сопутствующих (балластных) веществ.
3. Идентификация алкалоидов.
4. Количественное определение.
1. Изолирование алкалоидов из биологического материала можно проводить общими методами для группы «нелетучих» ядов - подкисленным спиртом, водой, подкисленной щавелевой кислотой, либо частным методом -водой, подкисленной серной кислотой, по В.Ф. Крамаренко. Для жидких алкалоидов, основания которых летучи с водяным паром, в качестве метода изолирования может быть применена перегонка с водяным паром. Для некоторых алкалоидов, например, для пахикарпина, разработан метод электродиализа.
Оптимальное значение рН для изолирования алкалоидов на 1 стадии - при настаивании биологического материала с полярными растворителями (вода или этанол) - должно быть 2 - 3, чтобы перевести алкалоиды в солеобразные ионизированные формы, хорошо растворимые в воде. При этом степень ионизации a 100%. Кислая реакция среды, кроме того, способствует разрушению комплексов алкалоидов с белками, что увеличивает выход алкалоидов.
На 2 стадии изолирования - при экстрагирования алкалоидов из жидкой фазы неполярным органическим растворителем - рН устанавливается в пределах 9 - 10, что дает возможность перевести алкалоиды из солей в основания, т.е. молекулярные формы, хорошо растворимые в органических растворителях. При этом a → 0%.
Оптимальным экстрагентом для большинства алкалоидов является хлороформ, для некоторых алкалоидов, например, морфина – смесь хлороформ: н-бутанол (9:1).
2. Очистка извлечений от балластных веществ.
Грубая очистка извлечений, содержащих алкалоиды, от балластных веществ, в частности белков, предусмотрена в некоторых методах изолирования. Так, в методе Стаса-Отто проводится осаждение белков абсолютным этанолом, а в методе В.Ф. Крамаренко - сульфатом аммония. Как правило, грубая очистка приводит к потерям алкалоидов за счет их соосаждения с белками.
К более тонким методам очистки относятся:
1. Экстракционная очистка.
2. Хроматография.
3. Электродиализ
1. Экстракционная очистка связана с экстракцией балластных веществ органическими растворителями из кислого водного раствора. При этом алкалоиды в виде солей остаются в водной фазе. Для выделения очищенных алкалоидов из водного раствора водную фазу подщелачивают гидроксидом аммония или натрия. При этом алкалоиды-соли переходят в алкалоиды-основания, которые экстрагируют органическим растворителем (хлороформом). Органическую фазу отделяют, растворитель испаряют, и остаток исследуют на наличие алкалоидов. При сильно загрязненных извлечениях очистку повторяют. Экстракционная очистка связана с частичными потерями алкалоидов за счет их перераспределения между водной и органической фазами. Такой вид очистки предусмотрен в методе В.Ф. Крамаренко, где балластные вещества экстрагируются из кислой водной фазы эфиром.
2 . Хроматографические методы очистки являются более экономичными по сравнению с экстракционными. Используются следующие разновидности метода:
• Адсорбционная колоночная хроматография (применена Л.М. Власенко для выделения и очистки морфина).
• Гель-хроматография - разновидность колоночной хроматографии (предложена В.Ф. Крамаренко)
• Хроматография в тонком слое сорбента (ХТС)
• Электрофорез - применен для выделения и очистки резерпина Л.В. Песаховичем.
Наибольшего внимания из перечисленных методов очистки заслуживает ТСХ благодаря своей доступности, простоте выполнения и высокой разрешающей способности.
3. Электродиализ применен Н.И. Вестфаль для очистки пахикарпина и стрихнина при выделении их из биологического материала. При этом в диализаторе создается электрическое поле, под действием которого ускоряется переход алкалоидов в водное извлечение через полупроницаемую мембрану, которая не пропускает крупные молекулы белков и продукты их распада, за счет чего и достигается очистка.
3. Идентификация выделенных алкалоидов.
С этой целью могут быть использованы как химические, так и физико-химические методы анализа.
План судебно-химического исследования на наличие алкалоидов включает следующие этапы:
а) Анализ начинают с общеалкалоидных осадительных реакций - в качестве предварительных групповых проб.
б) Затем проводят ХТС-скрининг - также в качестве предварительного теста, но более специфичного, благодаря индивидуальным величинам Rf для различных алкалоидов.
в) Далее выполняют частные реакции на отдельные алкалоиды – реакции окрашивания и микрокристаллические реакции.
г) Снимают спектральные характеристики алкалоидов в УФ и ИК-областях спектра.
д) Для некоторых алкалоидов проводят фармакологические пробы.
Исследование с общеалкалоидными осадительными реактивами проводится в качестве предварительных испытаний на наличие алкалоидов.
Применение этих реактивов основано на свойстве алкалоидов давать даже в разбавленных растворах простые или комплексные соли с некоторыми кислотами, солями тяжелых металлов, комплексными иодидами и рядом других соединений.
В литературе описано большое количество осадительных реактивов для алкалоидов. В настоящее время их известно более 250.
Общеалкалоидные осадительные реактивы делят на 2 большие группы:
1. Реактивы, дающие с алкалоидами простые соли:
1. Раствор таннина, пикриновая, пикролоновая и некоторые другие органические кислоты.
2. Реактивы, дающие с алкалоидами комплексные соединения, которые делятся на 2 подгруппы:
а) реактивы, содержащие в своем составе металлоиды:
1) I2/КI - реактив Бушарда-Вагнера,
2) Н3РО4 .12МоО3 - фосфорномолибденовая кислота (реактив Зонненшейна),
3) Н3РО4 . 12WО3 . 2Н2О- фосфорновольфрамовая кислота (реактив Шейблера).
б) реактивы, содержащие в своем составе металлы:
1)ВI3/КI-реактив Драгендорфа (К[ВiI4]),
2) CdI3/KI - реактив Марме (K2[CdI4]),
3) HgI2/KI - реактив Несслера (К2[НgI4]),
4) H2[PtCl4] - платинохлористоводородная кислота,
5) Н[АuCl4] - золотохлористоводородная кислота.
Чувствительность реактивов неодинакова по отношению к различным алкалоидам. Наиболее чувствительными и чаще всего применяемыми в судебно-химической практике являются реактивы Шейблера, Зонненшейна, Драгендорфа и Бушарда-Вагнера (чувствительность реакций лежит в пределах 0,1-0,01 мкг)
Обычно предварительные испытания на наличие алкалоидов проводят с двумя-тремя общеалкалоидными реактивами, чтобы получить достоверные результаты (т.к. не все алкалоиды одинаково реагируют со всеми реактивами, и реакции обладают различной чувствительностью). Реакции выполняются с солями алкалоидов. Для того, чтобы перевести алкалоид-основание, в виде которого он выделяется из биологического материала, в алкалоид-соль, остаток после испарения хлороформа растворяют в 1-2 каплях 0,1 М раствора HCl. Затем только добавляют реактив и наблюдают за результатом. При наличии алкалоидов наблюдается выпадение осадков или помутнение капли.
Судебно-химическая оценка реакций.
Все общеалкалоидные осадительные реактивы не являются специфичными для алкалоидов. Кроме алкалоидов, осадки с указанными реактивами дают другие
вещества, содержащие гетероатом азота (третичный). Это могут быть синтетические лекарственные вещества, белки и продукты их распада, аминокислоты и многие другие соединения. Исходя из этого, реакциям с общеалкалоидными осадительными реактивами придается только отрицательное судебно-химическое значение.
Отрицательный результат реакций дает основание эксперту-химику сделать заключение о ненахождении алкалоидов и исключить их из дальнейшего хода исследования.
Положительный результат (образование осадка) свидетельствует о присутствии в исследуемом объекте алкалоидов либо других азотсодержащих веществ основного характера и требует проведения подтверждающих исследований.
ТСХ-скрининг алкалоидов более специфичен по сравнению с общеалкалоидными осадительными реактивами, хотя ему также придается ориентирующее значение в связи с неспецифичностью реагентов-проявителей алкалоидов на хроматограмме. Хроматографирование проводится в закрепленном тонком слое сорбента – силикагеля. В качестве подвижной фазы используются системы растворителей:
- диоксан:хлороформ:ацетон:25% раствор аммиака (47,5:45:5:2,5),
- толуол:ацетон:этанол:25% раствор аммиака (45:45:7,5:2,5) – в экспресс-анализа интоксикаций,
- ацетон:хлороформ:25% раствор аммиака (24:12:1).
Пробег растворителей составляет 10 см. Детектирование алкалоидов и синтетических лекарственных веществ основного характера на хроматограмме проводится реактивом Драгендорфа. В зонах расположения веществ появляются красно-оранжевые пятна.
Чувствительность обнаружения составляет десятые доли микрограмма.
Идентификацию алкалоидов и синтетических лекарственных веществ проводят по величине Rf относительно метчиков. В качестве метчиков используют хлороформные растворы стандартных веществ с определенной концентрацией. Величины Rf большинства токсикологически важных алкалоидов и азотсодержащих веществ основного характера приведены в справочных таблицах.
Необходимость использования метчиков связана с колебаниями значений Rf ввиду трудностей соблюдения абсолютно стандартных условий хроматографического разделения.
ХТС-скринингу придается отрицательное судебно-химическое значение.
При отсутствии пятен на хроматограмме можно сделать заключение о ненахождении алкалоидов и других азотсодержащих лекарственных веществ основного характера и исключить их из дальнейшего хода исследования.
Совпадение величины Rf испытуемого вещества с величиной Rf метчика дает возможность сделать предварительное заключение об их идентичности. Последующее подтверждение присутствия алкалоида проводится более специфичными реакциями и методами.
В качестве подтверждающих реакций после хроматографического исследования используют реакции окрашивания и микрокристаллические реакции.
1. Реакции окрашивания основаны на следующих процессах:
а) отнятие воды (дегидратация) под действием концентрированной серной кислоты (вератрин, бруцин и др.),
б) окисление алкалоидов (кофеин - мурексидная проба, хинин - таллейохинная проба),
в) одновременное окисление и отнятие воды (реакция с калия дихроматом в присутствии концентрированной кислоты серной - на стрихнин),
г) конденсация с альдегидами (реактив Марки с опийными алкалоидами).
Чаще всего для реакций окрашивания используются:
1. Концентрированная кислота серная.
2. Концентрированная кислота азотная.
3. Смесь концентрированных серной и азотной кислот (реактив Эрдмана).
4. Формалинсерная кислота (реактив Марки).
5. Раствор молибдата аммония в концентрированной серной кислоте (реактив Фреде).
6. Раствор ванадиевой кислоты (ванадата аммония) в концентрированной серной кислоте (реактив Манделина).
Реакции окрашивания выполняются с основаниями алкалоидов Соответствующий реактив наносится на сухой остаток после испарения хлороформного извлечения.
Реакции окрашивания могут быть специфичными для некоторых алкалоидов (бруцин, вератрин), или могут давать возможность обнаружения группы алкалоидов. Например, реактив Марки является групповым реагентом на опийные алкалоиды. Большинство реактивов, используемых для реакций окрашивания, имеют в своем составе концентрированную серную кислоту, поэтому при исследовании сильно загрязненных остатков может наблюдаться обугливание соэкстрактивных органических веществ. Поэтому степень чистоты остатка имеет немаловажное значение.
Чувствительность реакций окрашивания составляет от нескольких мкг до сотых долей микрограмма.
2. Микрокристаллические реакции являются очень ценными для доказательства алкалоидов в судебно-химическом анализе. Они основаны на способности алкалоидов образовывать кристаллы характерной формы при взаимодействии с некоторыми кислотами (пикриновой, пикролоновой, платино- и золотохлористоводородной - H2[PtCl4], Н[АuCl4]), солями тяжелых металлов и комплексными йодидами.
Судебно-химическая оценка метода.
Микрокристаллические реакции обладают высокой чувствительностью, надежностью и доказательностью. Результаты их наглядны, они могут быть зафиксированы в виде фотографий и представлены судебно-следственным органам в качестве приложения к акту судебно-химической экспертизы.
Определение кристаллооптических констант образующихся продуктов значительно повышает надежность микрокристаллических реакций. В области кристаллооптического анализа алкалоидов большая работа проведена профессором В.Т. Поздняковой (Львовский медицинский институт). В ее монографии «Микрокристаллоскопический анализ фармацевтических препаратов и ядов» (1968 г.) рекомендован целый ряд микрокристаллических реакций на алкалоиды, пригодных для исследования биологического материала. Определены кристаллооптические константы продуктов реакций (угол погасания, знак удлинения, показатели преломления).
Являясь ценным методом доказательства алкалоидов, микрокристаллические реакции, в то же время, не лишены недостатков:
при исследовании биологического материала присутствие соэкстрактивных веществ приводит к появлению кристаллов нехарактерной формы, нарушаются кристаллооптические константы, отмечается полиморфизм (присутствие одновременно кристаллов различных форм), поэтому требуется высокая степень чистоты выделенных веществ. Значительное влияние на надежность метода оказывает квалификация химика, навык в выполнении этих реакций.
УФ- и ИК-спектроскопия является одним из наиболее важных способов идентификации алкалоидов. Для доказательства алкалоидов, выделенных из биологического материала, чаще используют УФ-спектроскопию как наиболее чувствительный метод. Гетероциклы, лежащие в основе строения отдельных групп алкалоидов, часто имеют характерные максимумы поглощения в УФ-свете. Так, производные пиридина имеют максимум при длине волны 260 нм, хинолина (изохинолина) – при 250, 290, 310 нм, индола – 260 (255) и 300 нм, пурина – 220, 260, 270 нм.
Спектральные методы анализа требуют высокой степени чистоты выделенных веществ и сочетаются с предварительной очисткой.
Фармакологические пробы
В том случае, если алкалоид оказывает характерное действие на живой организм, могут быть выполнены фармакологические пробы на животных, которые проводятся квалифицированным специалистом-фармакологом. Например, при доказательстве атропина капают водный раствор испытуемого вещества в глаз кошки. При наличии атропина наблюдается характерное стойкое расширение зрачка. Стрихнин и никотин, нанесенные на спинку лягушки, вызывают ее гибель в характерной позе («молящаяся лягушка» - стрихнин, «сидящая» - никотин).
Фармакологические пробы оказывают существенную помощь химику-эксперту при доказательстве алкалоидов. В ряде случаев эти пробы не менее чувствительны и более специфичны, чем химические реакции.
4. Количественное определение алкалоидов проводится фотометрическим и спектрофотометрическим методами (в видимой и УФ-областях спектра).
1. Определение в УФ-области (200-400 нм) проводится по специфическому поглощению (абсорбции) самого алкалоида при наличии у него хромофорной системы. Интенсивность поглощения пропорциональна концентрации. Расчет ведут по уравнению закона Бугера-Ламберта-Бера.
Определение проводится на спектрофотометре, т.к. закон Бера справедлив только для монохроматического излучения.
2. Определение в видимой области (400-700 нм) основано на измерении абсорбции окрашенных комплексов алкалоидов с кислотными реагентами (пикриновой кислотой, тропеолином 00, метиловым оранжевым, бромфеноловым синим и т.п.). В этом случае образуются ионные ассоциаты, для образования которых большое значение имеет рН среды, т.к. в момент реакции и алкалоиды, и реагенты должны быть ионизированы. Окрашенные ионные ассоциаты могут быть экстрагированы из водной фазы органическим растворителем. Такое определение носит название экстракционно-фотометрического.
Окрашенные продукты могут быть получены также в реакциях окисления, восстановления, конденсации, азосочетания и некоторых других.
Измерение абсорбции можно вести как на фотоэлектроколориметрах, так и на спектрофотометрах.
Расчет концентрации проводится по градуировочному графику. При использовании спектрофотометрии можно использовать уравнение Бугера-Ламберта-Бера.
Фотометрические методы анализа позволяют определять очень малые (несколько микрограммов) количества алкалоидов, но требуют высокой степени чистоты выделенного вещества, поэтому сочетаются с ТСХ- очисткой полученных извлечений.
АЛКАЛОИДЫ, ПРОИЗВОДНЫЕ ТРОПАНА
5.5.1. АТРОПИН
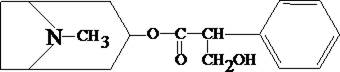
Атропин (сложный эфир троповой кислоты и тропина) содержится в красавке и скополии карниолийской и в некоторых др. растениях. Экстрагируется органическими растворителями из щелочных растворов.
ТОКСИКОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ
Токсикологическое значение атропина определяется как широким применением его в медицинской практике (возможность передозировки), так и широким распространением растении, содержащих производные тропана (отравление частями растений). В медицине атропин применяется в глазной практике как средство, расширяющее зрачок, а также как спазмолитическое при бронхиальной астме, спастических коликах и т. п.
Токсическое действие атропина и других алкалоидов этой группы характеризуется возбуждением, выражающимся в галлюцинациях, повышенной подвижности, громком бессознательном разговоре, смехе и т. п.; после такого возбуждения наступает угнетение. Атропин парализует также окончания парасимпатических нервов, иннервирующих мускулатуру (глаз, сердца, легких, желудка, кишечника), и железы (слюнные, потовые и др.). Впоследствии наступает расширение зрачков, сохраняющееся часто даже после смерти, нарушение зрения, сухость в носу, хрипота, кожа становится сухой и горячей; обнаруживаются и другие признаки отравления.
Смертельная доза для человека 0,1 г. Из организма атропин выводится с мочой.
Картина вскрытия трупа обычно малохарактерна. В доказательстве отравления важную роль может сыграть судсбно-фармакогностическое исследование остатков частей растений, если они найдены в желудке.
ФАРМАКОЛОГИЧЕСКОЕ ИСПЫТАНИЕ. Остаток после извлечения из щелочного раствора наносят на конъюнктиву глаза кошки или белой мыши. Для этого часть остатка растворяют в 1-3 каплях 1% раствора кислоты соляной и полученный раствор выпаривают без нагревания на часовом стекле. Затем остаток растворяют в 1-2 каплях воды и при помощи пипетки раствор наносят на слизистую оболочку (конъюнктиву) одного глаза кошки и наблюдают расширение зрачка. Другой глаз животного является контролем. Разница в величине зрачков особенно наглядна при поднесении к глазам яркого источника света. Расширение зрачка наступает обычно через 20-60 мин. Чувствительность реакции 0,02 мг. При очень малых количествах остатка реакцию удобнее производить на глазе белой мыши, но такое испытание требует большей подготовки и должно производиться фармакологом.
РЕАКЦИИ ОБНАРУЖЕНИЯ
1. Реакции с реактивами группового осаждения алкалоидов
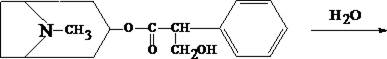
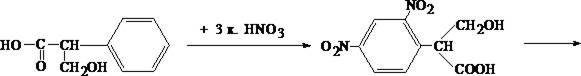
1.1. Реакция переведения атропина в полинитропроизводное и доказательство последнего (реакция Витали – Морена)
В фарфоровую чашку вносят несколько капель хлороформного раствора исследуемого вещества и при комнатной температуре выпаривают досуха. К сухому остатку прибавляют 1 мл концентрированной азотной кислоты, жидкость на кипящей водяной бане выпаривают досуха. При этом сухой остаток приобретает жёлтую окраску. К сухому остатку с одной стороны прибавляют 3 – 5 капель ацетона, а с другой 1 – 2 капли 10% спиртового раствора калия гидроксида. При соприкосновении указанных растворов с сухим остатком появляется быстроисчезающая фиолетовая окраска.
Реакция неспецифична. Открываемый минимум 1 мкг.
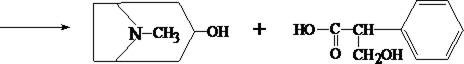
тропин троповая кислота
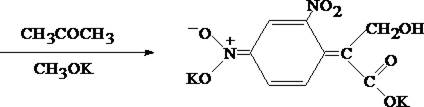
1.2. Гидроксамовая проба
К сухому остатку (после испарения хлороформа) добавляют едкий натр до рН = 11, затем добавляют гидроксиламин и доводят рН до 1, с помощью концентрированной хлороводородной кислоты, и прибавляют 2 – 3 капли раствора железа (III) хлорида. Наблюдают красное окрашивание.
Реакция неспецифична.
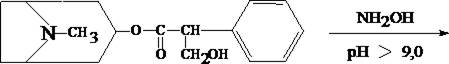
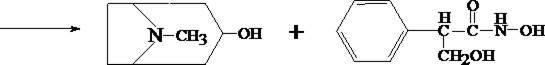
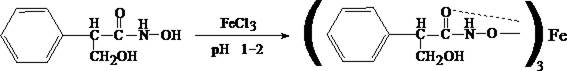
1.3. Реакция с п–диметиламинобензальдегидом и кислотой серной
К 2 –3 каплям исследуемого раствора прибавляют 3 – 5 капель 0,5% раствора п–диметиламинобензальдегида в концентрированной серной кислоте. Жидкость взбалтывают, а затем нагревают на кипящей водяной бане 5 – 10 мин. При наличии атропина появляется красная окраска, переходящая в вишнёво–красную, а затем и фиолетовую.
Реакция неспецифична.
МИКРОКРИСТАЛЛИЧЕСКИЕ РЕАКЦИИ
1. Реакция с солью Рейнеке
Сухой остаток исследуемого вещества растворяют в капле 0,1 моль/л раствора хлороводородной кислоты и соединяют на предметном стекле с каплей свежеприготовленного 1% раствора соли Рейнеке, выделяется аморфный сиреневого цвета осадок, быстро кристаллизующийся при стоянии. Образование сростков кристаллов с ромбовидными концами указывает на наличие атропина в пробе.
Открываемый минимум 0,1 мкг.
2. Реакция с пикриновой кислотой
Сухой остаток исследуемого вещества на предметном стекле растворяют в капле 0,1 моль/л раствора хлороводородной кислоты и соединяют с каплей 0,5% раствора пикриновой кислоты. При наличии атропина через 15 – 20 мин образуются тонкие пластинки пикрата атропина светло–жёлтого цвета, отдельные и собранные в сростки.
Открываемый минимум 5 мкг.
3. Реакция с бромной водой
Остаток исследуемого вещества обрабатывают каплей 0,1 моль/л раствора хлороводородной кислоты и каплей насыщенного раствора брома. В ту же минуту выделяется осадок, состоящий из жёлтых и красно–бурых кристаллов рисообразной и игольчатой формы. При стоянии препаратов кристаллы растворяются.
Открываемый минимум 0,016 мкг.
ФАРМАКОЛОГИЧЕСКИЕ ИСПЫТАНИЯ
При нанесении исследуемого раствора на конъюнктиву глаза кошки (мыши) наблюдают расширение зрачка.
5.5.2. СКОПОЛАМИН
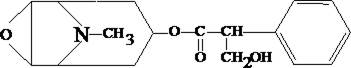
Скополамин относится к числу алкалоидов, которые содержатся в некоторых видах дурмана, скополии японской и др. Он представляет собой сложный эфир спирта скопина и троповой кислоты. Экстрагируется из щелочных растворов.
ТОКСИКОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ
Скополамин применяется в качестве успокаивающего и снотворного средства при состояниях моторного возбуждения, маниакальных состояниях, бессоннице.
По физиологическому действию скополамин напоминает атропин. Однако у скополамина более выражено действие на центральную нервную систему, а парасимпатический эффект менее стоек и проявляется лишь при больших дозах препарата. Смертельной дозой считают 0,1 г скополамина, но отмечается и повышенная чувствительность к нему (Э. Штаркенштейп, Э. Рост и И. Поль).
РЕАКЦИИ ОБНАРУЖЕНИЯ
1. Реакции с общеалкалоидными реактивами
1.1. Реакция Витали – Морена
1.2. Гидроксамовая проба
1.3. Реакция с солью Рейнеке
Дата добавления: 2015-08-01; просмотров: 3330;
