АЛКАЛОИДЫ, ПРОИЗВОДНЫЕ ИЗОХИНОЛИНА 2 страница
Из организма никотин выделяется с мочой, калом, а также легкими, частично потовыми и слюнными железами. Никотин обладает способностью проникать через плаценту. Обнаруживается в плоде. При внутримышечном введении крысам наибольшая концентрация его обнаруживается в головном и спинном мозге. Патологоанатомическая картина при отравлениях никотином нехарактерна.
В органах никотин сохраняется довольно долго. Вопросам распределения и биотрансформации никотина посвящена обширная литература. Основным метаболитом никотина в организме считают котинин, в малых количествах обнаружены оксикотинин и еще 6 других метаболитов.
РЕАКЦИИ ОБНАРУЖЕНИЯ
1. Реакции с реактивами группового осаждения алкалоидов
2. Реакция с формальдегидом
На часовое стекло наносят 1 – 2 капли исследуемого раствора и 2 капли 4% водного раствора формальдегида. Смесь нагревают, затем прибавляют каплю концентрированной кислоты азотной. В присутствии никотина раствор приобретает красную или розовую окраску.
3. Реакция с п–диметиламинобензальдегидом
На часовое стекло наносят каплю концентрированной хлороводородной кислоты, в которую вносят кристаллик п–диметиламинобензальдегида. Рядом с этой каплей помещают каплю исследуемого раствора, затем капли соединяют с помощью стеклянной палочки. При наличии никотина в месте соприкосновения капель наблюдается розовое окрашивание, которое переходит в фиолетовое. Окраска сохраняется около суток.
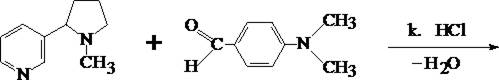
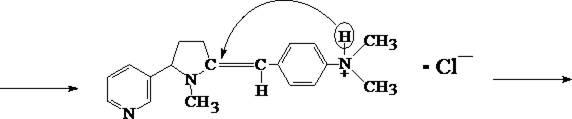
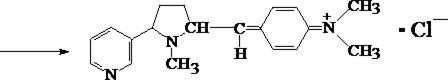
4. Реакция с реактивом Бушарда
К 2 – 3 каплям исследуемого раствора прибавляют каплю реактива Бушарда, выпадает осадок красного, буроватого цвета.
5. Реакция с пергидролем
В пробирку вносят 1 мл исследуемого раствора, 1 мл водорода пероксида 30% и 2 – 3 капли концентрированной кислоты серной. Появление красной или шоколадно–коричневой окраски указывает на присутствие никотина.

6. Реакция с ванилином
К 1 мл исследуемого раствора прибавляют кристаллик ванилина и 1 – 2 капли концентрированной хлороводородной кислоты, появление красной или вишнёво–красной окраски указывает на присутствие никотина.
Механизм реакции схож с реакцией 3.
7. Реакция образования полиметинового красителя
KCNS + Br2 ® BrCNS + KBr
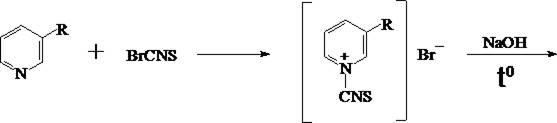
роданопиридиния
бромид
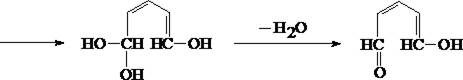
глутаконовый
альдегид

Микрокристаллические реакции
1. Реакция с реактивом Драгендорфа
(Методику выполнения см. кокаин). При наличии никотина наблюдаются сростки кристаллов в виде летящих птиц, буквы «К» или буквы «Х».
Открываемый минимум 1 мкг.
2. Реакция с солью Рейнеке
К сухому остатку на предметном стекле прибавляют каплю 0,01 моль/л раствора кислоты хлороводородной и каплю свежеприготовленного 1 % раствора соли Рейнеке. При наличии никотина образуются сферические сростки, состоящие из призматических кристаллов.
Открываемый минимум 1,2 мкг.
3. Реакция образования пикрата никотина
(Методику выполнения см. ареколин).
Открываемый минимум 3,3 мкг.
4. Реакция с раствором йода в этиловом эфире
В пробирку вносят 1 мл раствора исследуемого вещества в этиловом эфире и прибавляют 1 мл 1% раствора йода в этиловом эфире. Через несколько минут смесь мутнеет, а затем выпадает смолистый осадок, из которого выделяются игольчатые рубиново–красные кристаллы с тёмно–синим оттенком.
Фармакологическое испытание
Очищенный раствор (извлечение) наносят на спинку лягушки. При отравлении никотином лягушка принимает характерную позу (сидячее положение, расставив верхние и нижние лапки). Это испытание должен производить специалист – фармаколог.
5.5.21. АНАБАЗИН
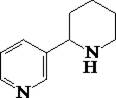
Это алкалоид, который содержится в ежовнике безлистном. Представляет собой бесцветную маслянистую жидкость, хорошо растворимую в воде и ряде органических растворителей. Экстрагируется также как никотин
Реакции обнаружения
1. Реакции с реактивами группового осаждения алкалоидов
2. Реакция с реактивом Бушарда
3. Реакция с пергидролем
4. Реакция с ванилином
5. Реакция образования полиметинового красителя
(Выполнение реакций 2 – 5 см. никотин)
Микрокристаллические реакции
1. Реакция с реактивом Драгендорфа
(Выполнение реакции см. кониин). Появление сростков, состоящих из оранжево–красных кристаллов, имеющих форму пик, указывает на наличие анабазина в растворе.
Открываемый минимум 1 мкг.
2. Реакция с солью Рейнеке
(Выполнение реакции см. никотин). При наличии анабазина наблюдаются сростки, состоящие из мелких игольчатых кристаллов.
Открываемый минимум 0,7 мкг.
3. Реакция с пикриновой кислотой
К капле исследуемого раствора прибавляют 2 капли насыщенного раствора пикриновой кислоты. При наличии анабазина в растворе выпадает жёлтый кристаллический осадок.
Открываемый минимум 4 мкг.
СТЕРОИДОПОДОБНЫЕ АЛКАЛОИДЫ
5.5.22. ВЕРАТРИН
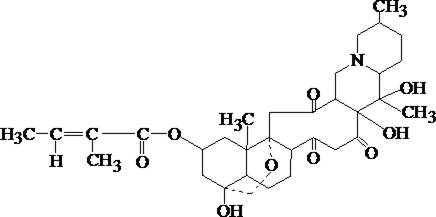
Вератрин – сумма алкалоидов (сложные эфиры вератровой или ангеликовой кислот), главным из которых является протовератрин.
Реакции обнаружения
1. Реакция с концентрированной серной кислотой
К сухому остатку на фарфоровой чашке после удаления растворителя добавляют 1 каплю концентрированной серной кислоты. Наблюдают быстрый переход окраски от жёлтой к оранжевой и красной, через 20 – 30 мин наблюдают вишнёво–красное окрашивание.
2. Реакция с концентрированной хлороводородной кислотой
К сухому остатку на фарфоровой чашке добавляют 1 – 2 капли концентрированной хлороводородной кислоты. Через насколько минут наблюдают стойкое вишнёво–красное окрашивание.
АЦИКЛИЧЕСКИЕ АЛКАЛОИДЫ
5.5.23. ЭФЕДРИН

Один из алкалоидов различных видов эфедры. Экстрагируется из щелочных растворов.
Реакции обнаружения
1. Реакции с реактивами группового осаждения алкалоидов
2. Реакция с солями меди и сероуглеродом
В микропробирку вносят каплю раствора исследуемого вещества, подкисленного уксусной кислотой, прибавляют каплю 5% раствора меди сульфата, а затем раствор аммония гидроксида до щелочной реакции. К полученному раствору прибавляют 2 капли смеси сероуглерода и бензола (1:3) и взбалтывают. При наличии эфедрина бензольный слой приобретает коричневую или жёлтую окраску.
Открываемый минимум 2 мкг.

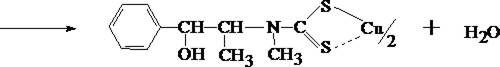
3. Реакция с 2, 4 – динитрохлорбензолом
В микропобирку вносят каплю эфирного раствора исследуемого вещества, прибавляют каплю 5 моль/л раствора едкого натра и каплю 5% спиртового раствора 2, 4 – динитрохлорбензола. Жидкость нагревают на водяной бане в течение 5 мин. При наличии эфедрина в растворе появляется жёлто–коричневая окраска. Если к охлаждённому раствору прибавить 1 – 2 капли раствора хлороформа и несколько капель разведённой уксусной кислоты, а затем взболтать, то хлороформный слой приобретает жёлтую окраску.
Открываемый минимум 5 мкг.
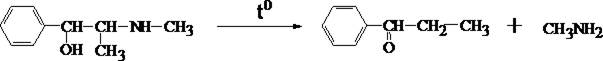
4. Реакция с реактивом Либермана
К сухому остатку на фарфоровой чашке после удаления растворителя добавляют 1 каплю реактива Либермана (натрия нитрит в концентрированной серной кислоте). Наблюдают появление жёлтого окрашивания.
Микрокристаллические реакции
1. Реакция с реактивом Драгендорфа
Сухой остаток на предметном стекле растворяют в 1 капле 0,1 моль/л раствора хлороводородной кислоты и добавляют 1 каплю реактива Драгендорфа. Через 10 – 15 мин под микроскопом наблюдают пучки из тонких игольчатых кристаллов и пластинки неправильной формы тёмно–коричневого цвета.
Открываемый минимум 15,6 мкг.
2. Реакция с солью Рейнеке
Сухой остаток на предметном стекле растворяют в 1 капле 0,1 моль/л раствора хлороводородной кислоты и добавляют 1 каплю свежеприготовленного 1% раствора соли Рейнеке. Быстро выделяется аморфный сиреневый осадок, кристаллизующийся при стоянии в сростки из прямоугольных пластинок.
5.5.24. ПРОИЗВОДНЫЕ ФЕНОТИАЗИНА

Таблица 4. Производные фенотиазина
| Исследуемое вещество | R1 | R2 |
| Аминазин | Cl | 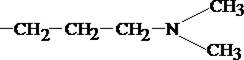
|
| Дипразин | H | 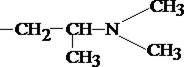
|
| Этаперазин | H | 
|
| Трифтазин | CF3 | 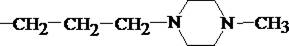
|
Физико-химические свойства
Представляют собой белые или желтоватые кристаллические порошки, хорошо растворимые в воде и этаноле, получаемые синтетическим путем. Они экстрагируются органическими растворителями из щелочных водных растворов.
Основной характер производных фенотиазина обусловлен наличием в структуре молекулы гетероциклического атома азота (с рКа 4) и третичного атома азота в алифатическом радикале (рКа 9,1-9,8).
При взаимодействии с кислотами фенотиазины образуют соли, легко растворимые в воде, спирте, хлороформе, но практически нерастворимые в эфире и бензоле.
Основания представляют собой сиропообразную массу, нерастворимую в воде, но растворимую а спирте, эфире, хлороформе, этилацетате.
Логарифм распределения (log P) основания аминазина в системе октанол-вода и хлороформ-вода соответственно равны 5,16 и 1,09, хлористоводородной соли аминазина – 1,51 и 1,22. Для дипразина log P в системе циклогексан-вода и хлороформ-вода – 1,5 и 1,22.
Абсорбция производных фенотиазина в УФ-области спектра характеризуется наличием 2 максимумов: λ мах. 1. 250-260 нм (ε 35000); 2. 300-315 нм (ε 4500)
Сравнение УФ-спектров солей производных фенотиазина со спектрами их оснований показывает, что они практически идентичны. Следовательно, их УФ-спектры отражают только электронную структуру фенотиазиновой части молекулы (хлорпромазин, прометазин).
Исключение представляют те производные, которые во 2-ом положении содержат радикалы со свободными n-электронами (тиоридазин, левомепромазин).
Сульфоксиды фенотиазинов имеют в отличие от нативных (основных) соединений 4 максимума в УФ-области: 230,265,285 и 400 нм.
Фармакокинетика
Всасываются фенотиазины как вещества основного характера преимущественно из кишечника. Гидрофобный характер оснований фенотиазинов способствует взаимодействию их с белками. Кажущийся объем, распределения (Vр) приближается к 100%, поэтому, фенотиазины локализуются в тканях органов (мозг, печень, почки). Выводятся почками, в моче обнаруживается в основном в виде метаболитов.
Метаболизм фенотиазинов протекает в 3-х направлениях:
1 путь - трансформация в радикалах R1 и R2
а) N-O-S-деметилирование, которое приводит к увеличению полярности соединений;
б) окисление N10-боковой цепи.
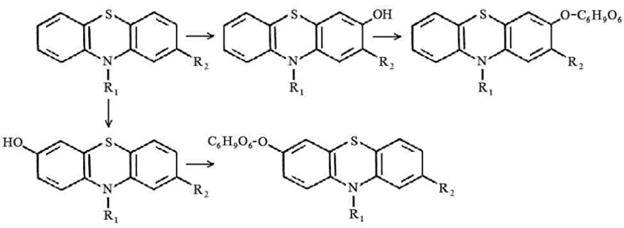
2 путь - окисление гетероциклического атома серы в сульфоксид или сульфон Сульфоокисление - образование сульфоксидов со степенью окисления 4 и 6.
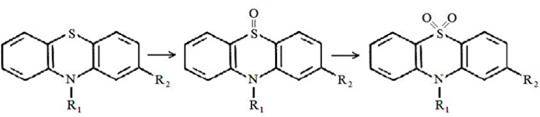
3 путь - ароматическое гидроксилирование в положениях 3, 6 с последующим конъюгированием с глюкуроновой кислотой.
Токсическая доза для производных фенотиазина в среднем колеблется от 15 до 150 мг/кг.
Анализ фенотиазинов.
Обнаружение проводят по общей схеме идентификации лекарственных соединений:
1. Реакции осаждения
Как соединения, содержащие гетероциклический атом азота, фенотиазины образуют с общеалкалоидными осадочными реактивами как простые (с пикриновой и пикролоновой кислотами), так и комплексные соли (с солью Рейнеке, с солями висмута и золота). Наиболее часто используется для обнаружения веществ основного характера раствор йода в йодиде висмута (р-в Драгендорфа).
2. Микрокристаллические реакции: аминазин и дипразин с 5% р-ром хлорного золота образуют характерные кристаллические осадки. Большинство фенотиазинов дают кристаллические осадки с солью Рейнеке, однако дифференциация отдельных представителей этой группы по форме кристаллов затруднительна.
3. Реакции окрашивания
В основе реакций окрашивания лежат следующие химические процессы: - дегидрирование в присутствии кислот (конц. серная кислота);
- каталитическое окисление (HClO4+ NaNO2, р-в Фреде, р-в Манделина и др.);
- конденсация с альдегидами в присутствии водоотнимающих средств (р-в Марки);
- окисление солями металлов с высшей степенью валентности и HPtCl4).
Таблица 5. Реакции окрашивания производных фенотиазина
| Название препарата | H2SO4 к. | HClO4 + NaNO2 | H2SO4 к. + формальдегид | 10% р-р H2PtCl6 |
| Хлорпромазин | малиновое | малиновое | розово-малиновое | сиреневое с фиолетовым осадком |
| Прометазин | малиновое | розово-малиновое | желто-оранжевое | серо-синее с розовым осадком |
| Тиоридазин | бледно-голубое | зелено-голубое | цвет морской волны | бледно-сиреневое |
| Левомепромазин | фиолетовое | фиолетовое | фиолетовое | ярко-зеленое |
ГХ-анализ
Разделение производных фенотиазина проводят на фазе средней полярности OV-225 (3-5% на хроматоне), в стеклянных микроколонках длиной 1-2 м при 200-250оС. Температура инжектора 250-300оС. Детектор азотнофосфорный (чувствительность 0,006 мкг/мкл), а для хлорсодержащих – по захвату электронов (чувствительность – 0,001). Внутренний стандарт - имизин.
Фотометрия в видимой области спектра
В основу этих методов положено измерение поглощения окрашенных продуктов реакции производных фенотиазина:
- с конц. H2SO4 – эта методика нашла наиболее широкое применение. Недостаток метода – возможность обугливания при наличии соэкстрактивных веществ, особенно при использовании гнилостно-разложившегося биологического материала (аминазин, дипразин);
- с реактивом Манделина и конц. H2SO4. Методика используется для производных фенотиазина, которые с конц. H2SO4 дают нестабильное окрашивание с невоспроизводимыми значениями оптической плотности (тиоридазин, левомепромазин);
- с 18% р-ром кислоты соляной и 1 м р-ром кислоты мышьяковой.Реакция не уступает по чувствительности первым двум методам, однако мягкие условия окисления исключают возможность обугливания соэкстрактивных веществ (тиоридазин, френолон).
Фотометрия в УФ-области спектра
Этот метод требует высокой степени очистки извлечения и обычно сочетается с ТСХ. Измерение проводят при λмах 250-255нм в раствора 0,5 М. H2SO4. Из биологического материала производные фенотиазина (соединения основного характера) выделяют этиловым спиртом, подкисленным 10%-м спиртовым раствором кислоты щавелевой (рН=2-3), очищают жидкость-жидкостной экстракцией. Анализ проводится, как и в случае 1,4-бензодиазепинов, – деструкция при 100-120 0С в течение 30-60 мин в среде 6 М. HCl, затем - экстракция в органический растворитель или метод Стаса-Отто.
Изолирование из мочи и крови
Раздельно 5-10 мл мочи и 2 мл крови подщелачивают 50% раствором едкого натра до рН 13 и смесь кипятят в течение 10 минут на водяной бане. Полученный гидролизат охлаждается до комнатной температуры и дважды (по 20 мл) извлекается н-гептаном, содержащим 3% изоамилового спирта. Гептановые извлечения из мочи объединяют, промывают водой, насыщенной гептаном и делят на две равные части. В одной части проводится обнаружение производных фенотиазина методом тонкослойной хроматографии в системах 3 и 4, а в другой – количественное определение. Экстракт из крови полностью расходуется на количественное определение, т.к. содержит меньшее количество соэкстрактивных веществ.
Хроматографичесткая очистка и обнаружение в тонких слоях
Из аликвоты органического экстракта удаляют в токе теплого воздуха органический растворитель. Сухой остаток растворяют в 0,2-0,5 мл хлороформа и полученный раствор поровну наносят на две пластинки «Силуфол». В качестве метчиков наносят аминазин (обязательно) и те производные фенотиазина, которые были обнаружены в процессе предварительного исследования. Хроматографирование проводят в системе 1 и 2. Длина пробега – 10 см. Одну пластинку опрыскивают раствором конц. H2SO4 в этаноле (1:9) и при положительном результате на второй пластинке обнаружение проводят прокапыванием реактивом Марки.
Таблица 6. Величины и окраски пятен производных фенотиазина
| Соединение | Детекция | Системы растворителей | ||
| конц. H2SO4 в этаноле (1:9) | реактив Марки | |||
| Rst | Rst | |||
| Аминазин Дипразин Динезин Пропазин Левомепромазин Мажептил Мепазил Трифтазин Этаперазин Френолон | темно-красное темно-красное красное красное голубое красное красное красное темно-красное красное | темно-красное темно-красное красное красное голубое красное красное красное темно-красное красное | 1,00 0,74 2,10 1,29 1,56 0,08 1,47 0,48 0,34 1,71 | 1,00 2,95 2,95 1,08 1,87 0,13 1,60 0,26 0,48 3,21 |
Система 1: бензол-диоксан-25% аммиак – (60:35:5)
Система 2: этилацетат-ацетон-25% аммиак в этаноле (1:1) – (50:45:5)
Качественное обнаружение
1. С растворами йодида висмута в йодиде калия и фосфорно-молибденовой кислоты получаются аморфные осадки.
2. С концентрированной серной кислотой возникает устойчивое пурпурно-красное окрашивание.
При отрицательном результате двух первых реакций можно сделать заключение о необнаружении аминазина.
3. С формалинсерной кислотой аминазин дает пурпурно-красное окрашивание, усиливающееся при стоянии.
4. С концентрированной азотной кислотой возникает быстро исчезающее пурпурно-красное окрашивание.
5. С 5% раствором золотохлористоводородной кислоты (после 3—4-кратной обработки остатка основания аминазина 0,1 М. раствором НС1) выделяется темно-красный аморфный осадок, переходящий через 20-50 минут в характерный кристаллический. Кристаллы в виде палочек и сростков из них, напоминающих снопы и сфероиды. Кристаллы оптически активны, погасание косое, угол погасания 20-30°, удлинение кристаллов положительное.
Количественное определение
Количественное определение производных фенотиазина проводится без предварительной хроматографической очистки и разделения только в случае, когда установлено отсутствие в биообъекте других веществ основного характера. При их наличии для количественного определения производных фенотиазина проводят хроматографическую очистку методом ТСХ. Для этого на хроматографическую пластинку на стартовую линию, наносят в виде сплошной полосы шириной 1 см всю аликвоту экстракта для количественного определения к хроматографируют в системе 2. По окончании хроматографирования в УФ-свете отмечают зону соединения с соответствующим Rf, параллельно метчикам, снимают слой сорбента, содержащего соединение скальпелем в пробирку. Элюирование проводят 10 мл раствора 25% аммиака в этаноле (1:1) элюат отделяют фильтрованием через стеклянный фильтр № 4, упаривают досуха в токе холодного воздуха. Сухой остаток растворяют в 5 мл 0,1 М. раствора HCl, затем добавляют 4 мл 0,01 М. НCl.
В случае отсутствия других веществ основного характера вторую часть гептанового извлечения (кровь, моча) реэкстрагируют 5 мл 0,1 М. HCl, а затем 4 мл 0,01 М. НCl. Солянокислые растворы объединяют.
К объединенному солянокислому раствору добавляют 12 мл ацетатного буферного раствора (рН 3,5), 2 мл насыщенного раствора метилоранжа и 5 мл хлороформа. Полученная смесь взбалтывается в делительной воронке – при наличии производных фенотиазина хлороформный слой окрашивается в желтый цвет (гелиантаты производных фенотиазина, извлекаемые хлороформом). Хлороформный слой отделяется и определяется оптическая плотность окрашенного раствора (фотоэлектроколориметр ФЭК-56 и др., кювета 10 мм, светофильтр синий с максимумом пропускания при 400 нм).
Для построения калибровочной кривой готовят стандартные растворы в 0,01 М. НСl производных фенотиазина с содержанием 1,2-10 мкг/мл производных: фенотиазина и исследуют их вышеприведенной процедурой. На основании результатов определения оптической плотности строится калибровочный график. Вышеприведенным методом изолируется до 60% производных фенотиазина из крови и до 80% из мочи.
Количественное определение аминазина и его метаболитов
1. Фотоколориметрическое определение основано на реакции с концентрированной серной кислотой. Фотометрирование проводят при λ = 508 нм; эталон сравнения – контрольный опыт. Расчет содержания аминазина и его метаболитов производится по калибровочному графику.
2. Спектрофотометрическое обнаружение. Ультрафиолетовый спектр снимается в диапазоне длин вол 220-400 нм на СФ-4, СФ-4А и др. при концентрации 10 мкг/мл в пересчете на основание.
Максимумы абсорбции неизмененного аминазина при λmax = 254-255 нм (макс.) и λmin = 300-305 нм (мин). Неизмененный аминазин обычно обнаруживается в желудке и желудочно-кишечном тракте и их содержимом. Основной метаболит – сульфоксид – имеет максимумы абсорбции при длинах волн 238-240, 273; 298 и 340 нм. Химико-токсикологическим анализом по описанной методике обнаруживается 53-60% аминазина, добавленного к органам. Граница обнаружения 0,2 мг, граница определения 0,5 мг аминазина в 100 г органов.
Обнаружение фенотиазинов
Фенотиазины часто обнаруживают с помощью тонкослойной хроматографии щелочных экстрактов мочи, но при пероральном поступлении в организм специфическая идентификация этого соединения может оказаться невозможной, если для анализа имеется только моча. Фенотиазины, принимаемые в низких дозах, например флуфеназин, невозможно обнаружить в моче ни одним из известных методов.
Качественный анализ
а) Реакции осаждения - общеалкалоидные осаждающие реактивы (часто реактив Драгендорфа) +соль Рейнеке, Bi, Au.
б) Микрокристаллические реакции - 5% раствор хлорного золота дает характерные кристаллические осадки +соль Рейнеке дает характерные кристаллические осадки
в) Реакции окрашивания:
1) Дегидрирование в присутствии концентрированных кислот (H2SO4):
Элениум – малиновое окрашивание; Тиоридазин – голубое; Левомепромазин – фиолетовое.
2) Каталитическое окисление (HСlO4+NaNO2, реактив Фреде, реактив Манделина): Элениум – малиновое окрашивание; Тиоридазин – зеленовато-голубое; Левомепромазин – фиолетовое.
3) Конденсация с альдегидами в присутствии водоотнимающих средств (реактив Марки):
Элениум – розово-малиновое окрашивание; Тиоридазин – цвет морской волны; Левомепромазин – фиолетовое.
4) окисление солями металлов, имеющих высшую степень окисления (FeCl3 и HPtCl4)
В основе теста лежит реакция многих из этих соединений с ионами трехвалентного железа в кислой среде. Предпринимается для исследования мочи, содержимого желудка и остатков веществ с места происшествия.
а) Реактив FPN (FeCl3+ HClO4+ HNO3). Цвета, варьирующие от розового, красного или оранжевого до фиолетового или синего, могут свидетельствовать о присутствии фенотиазинов или их метаболитов. Моча пациентов, регулярно принимающих в лечебных целях традиционные фенотиазины, например хлорпромазин, обычно дает положительную реакцию. Чувствительность Хлорпромазин, 25 мг/л.
б) Элениум + HPtCl4 → фиолетовый осадок; Тиоридазин – серо-розовый осадок; Левомепромазин –ярко-зеленое окрашивание.
г) Газохроматографический анализ (ГХ)
Разделение ведут в среднеполярной фазе OV-225 на хроматоне в стеклянных микроколонках l = 1-2 м при температуре 200-250 оС, температура инжектора 250-300 оС. Детектор – азотно-фосфорный; для хлорсодержащих фенотиазинов – по захвату электрона. Внутренний стандарт – имизин.
д) Фотометрия в видимой области
В основе – получение окрашенного раствора (с кислотой H2SO4, с реактивом Манделина, с 18% HCl и 1М раствором мышьяковой кислоты).
е) Фотометрия в УФ области спектра.
Метод требует высокой очистки (сочетание с ТСХ). Измерение ведут в растворе 0.5 М H2SO4 (λmax=250–255 нм)
Пример. Краткая информация для составления схемы ХТА аминазина.
Аминазин относится к производным фенотиазина. Является веществом основного характера. Аминазин всасывается преимущественно из кишечника. Локализуется в тканях мозга, печени, почек. Выводится почками, в моче обнаруживается в основном в виде метаболитов.
Метаболизм протекает в трех направлениях:
1. Окисление N10 – боковой цепи.
- CH2-CH 2-CH2-N( CH3 )2 → CH2-CH2-CH2-NH2 → дезаминирование.
2. Сульфоокисление.
3. Ароматическое гидроксилирование в 3 и 6 положениях с последующим коньюгированием с глюкуроновой кислотой.
Дата добавления: 2015-08-01; просмотров: 3804;
