ПЕСТИЦИДЫ КАК ХИМИЧЕСКИЕ ЗАГРЯЗНИТЕЛИ
В настоящее время химия и технология пестицидов - одна из самых динамичных областей хозяйственной деятельности человека.
Пестициды - общее название всех химических соединений, которые применяются в сельском хозяйстве для защиты культурных растений от вредных организмов (англ. Pestis - паразиты, cide - уничтожать). Главной их сферой применения является растениеводство.
Ежегодно половину мировых запасов продовольствия съедают или повреждают насекомые, микроорганизмы, преимущественно плесневые микрогрибы, грызуны, птицы и другие вредители: они уничтожают урожай и в поле, и при уборке и отгрузке, и во время хранения. Считают, что в случае успешной борьбы с насекомыми, микроорганизмами болезнями, которые поражают зерновые культуры в поле, ежегодная прибавка урожая составила бы около 200 млн. тонн зерна, которой хватило бы для пропитания 1 млрд. человек.
Применение пестицидов в экономически развитых странах прочно вошло в практику возделывания основных сельскохозяйственных, культур. Оборот пестицидов в мире возрос за 5 лет на 17%, с 26,8 млрд. $ в 1991г. до 31,3 млрд. $ в 1996 г. К 2001 году оборот пестицидов составил 38,5 млрд., что соответствует ежегодному приросту на 4,2%. Этот рост, главным образом, обусловлен увеличением потребления пестицидов в США, Западной Европе, Японии.
В 1996 г. в мире было произведено 2,4 млн. тонн пестицидов. Основными производителями и потребителями пестицидов являются страны Северной Америки (30% оборота), Западной Европы (26%), Япония и Китай (24%). Оборот пестицидов в странах Восточной Европы и бывшего СССР составил около 5%
В мире ежегодно подвергается испытаниям около 500 тыс. различных химических соединений на пестицидную активность, причем из этого огромного числа практический выход получают всего 10-15 новых пестицидов. Показательны также объемы затрат на научно-исследовательские работы в этой облает экономически развитых странах они составляют 2 млрд. $, что соответствует 10 - 15% от суммы реализации готовой продукции. За последние годы в России в области поиска химических средств защиты растений объединены усилия 150 научных организаций страны. Это позволило осуществить синтез и провести биологические испытания более 60000 химических соединений.
Во всем мире в среднем за год применяется около 3,2 млн. тонн гербицидов, фунгицидов и инсектицидов (в среднем, по 0,5 кг на одного жителя планеты).
Наряду с безусловно полезными свойствами пестицидов следует отметить отрицательные стороны их применения. Перечень неблагоприятных последствий широкого применения пестицидов велик - загрязнение воды, почвы, продуктов питания, хронические заболевания и острые отравления, врожденные аномалии развития, детская смертность и т.д.
Применение химических средств защиты растений ставит четыре острые проблемы:
Первая из них связана с тем, что определенные пестициды, например, ДДТ и ртутьорганические соединения, имеют тенденцию накапливаться в живых организмах. В некоторых случаях пестициды не только накапливаются в организме в количестве большем, чем в окружающей среде, но их концентрация возрастает по мере продвижения по пищевым цепям. Это явление называют эффектом биологического усиления.
ДДТ служит примером биологически усиливающегося пестицида. Когда в организм животного попадает ДДТ с водой, с остатками уже обработанных растений или насекомыми, которые питались такими растениями, он концентрируется в жировых тканях, так как ДДТ растворим в жирах. Из жировых тканей ДДТ выводится очень медленно. Если какой-то другой организм в цепи поедает первый, то он в этом случае поглощает уже более высокую дозу ДДТ.
Биологическое усиление ДДТ в пищевой цепи
Питающаяся рыбой птица ↑ 3 - 76 млн-1 ДДТ
|
Крупная рыба |1 - 2 млн-1 ДДТ
|
Мелкая рыба |0,2 -1,2 млн-1 ДДТ
|
Планктон |0,04 млн-1 ДДТ
|
Вода | 0,00005 млн-1 ДДТ
Организмы, находящиеся на вершинах пищевых цепей (например, человек или хищные птицы), поедают пищу, в которой ДДТ содержится в значительно более высоких концентрациях, чем обычно в окружающей среде. Одним из последствий накопления ДДТ в организме птиц является то, что они откладывают яйца значительно более тонкой скорлупой. Тонкая скорлупа легко разбивается и может защитить развивающегося в яйце птенца. ДДТ широко мигрирует по земному шару. Заметные количества ДДТ обнаружены в моллюсках, рыбах, птицах, тюленях Северного и Балтийского морей, а также в антарктических рыбах, птицах и ластоногих. Пингвины Антарктиды, например, содержат в своем теле ДДТ в концентрации 0, 024 мг/кг.
Накопление ДДТ в фитопланктоне мирового океана уже при нескольких мкг/л из-за ничтожно низкой растворимости его в воде в значительной степени ингибирует процесс фотосинтеза. При широком использовании этого пестицида последствия этого явления могут стать непредсказуемыми, так как фитопланктон производит около 70% земного кислорода.
Взрослый житель ФРГ в среднем содержит в своем организме 4 мг ДДТ на 1 кг жира, житель США – примерно в 2,5 раза больше, накапливаясь, прежде всего в жировой ткани органов, где присутствуют жироподобные (липидные) вещества, то есть в печени, сердце, нервной системе и клетках мозга.
Вторая проблема связана с продолжительностью сохранения пестицидов в почве или на культурных растениях после обработки. Хлорированные углеводороды, такие как ДДТ, и пестициды, содержащие мышьяк, свинец или ртуть, относятся к группе устойчивых, они не разрушаются за время одного вегетационного сезона под действием солнца, экзоферментов или микроорганизмов.
Период полужизни у ДДТ, например, может продолжаться до 20 лет. За этот период только половина первоначально использованного ДДТ разложится до простых соединений. Широкий спектр воздействия и устойчивость ДДТ способствовали его накоплению в пищевых целях, что оказывало губительное действие на их концевые звенья. Когда в США концентрация ДДТ в молоке кормящих матерей в результате передачи этого вещества через пищевые цепи достигла уровня в 4 раза выше предельно допустимого, применение ДДТ было запрещено. Далее ДДТ был запрещен в Новой Зеландии, СССР, Венгрии, Швеции, Дании, Финляндии и в других странах. Правда, не всегда запреты были полными и неограниченными. Например, в СССР вначале не могли отказаться от использования ДДТ в борьбе с клещами - переносчиками таежного энцефалита, так как не было другого подходящего акарицида. Позже ВОЗ разрешила применение ДДТ в беднейших развивающихся странах для борьбы с переносчиками болезней - малярийными комарами и мухами. До сих пор ДДТ используют в Австралии, Китае, Индии для опрыскивания садов. При этом индийское правительство считает, что новый подъем заболеваемости малярией - это следствие запрета или ограничения на применение ДДТ.
Экспериментально было установлено, что ДДТ может вызвать генетические изменения в человеческом организме. Другие компоненты пестицидов - ртуть и мышьяк практически никогда полностью не инактивируются: они циркулируют в экосистеме или оказываются захороненными в иле.
Длительная устойчивость пестицидов является основным фактором процессе вторичного загрязнения, когда объекты, никогда не подвергавшиеся обработке пестицидами, тем не менее их содержат.
Циркуляция пестицидов может происходить по следующим схемам:
воздух --- растения --- почва --- растения --- травоядные животные--- человек;
почва --- вода ---зоофитопланктон---рыба --- человек.
Ирригационные воды Кубанских оросительных систем с остатками пестицидов после их использования сбрасываются в Приазовские лиманы, в воде которых токсиканты отсутствуют или обнаруживаются в незначительных количествах, но повсеместно и в больших концентрациях они присутствуют в донных осадках, водорослях и отдельных органах промысловых рыб.
Таким образом, пестициды, являясь важным фактором воздействия человека на окружающую среду, опасны тем, что могут оказывать на различные отдаленные побочные воздействия.
Обследование, проведенное во Франции в начале 80-х годов, показало, что в большинстве случаев нагрузка хлорорганических и фосфорорганических пестицидов создается из-за поступления в организм человека с продуктами растительного и животного происхождения.
Таблица 1. «Отдаленные воздействия пестицидов на окружающую среду»
| Элементы окружающей среды | По Потенциальные побочные явления |
| Абиотическая окружающая среда | Наличие остаточных количеств в почве, воде и воздухе |
| Растения | -Наличие остаточных количеств -Повреждения из-за фитотоксичности -Изменения в вегетационном развитии (при использовании гербицидов) |
| Животные | -Наличие остаточных количеств в домашних и диких животных -Физиологические воздействия (нежизнеспособность яиц птиц) -Смертность определенных диких видов (млекопитающих, птиц, рыб) -Смертность полезных, вредных и паразитирующих насекомых -Изменение численности насекомых (развитие вредителей второго поколения в результате смертности полезных, вредных и паразитирующих насекомых) |
| Человек | -Наличие остаточных количеств в тканях и органах -Профессиональные заболевания |
| Пища | -Наличие остаточных количеств |
| Организмы, с которыми ведется борьба | -Развитие резистентности |
Пестицидная нагрузка на человека в разных странах различна в зависимости от ассортимента потребляемых продуктов, принятой системы защиты растений и регламентирования остаточного содержания пестицидов в пищевых продуктах. Допустимые остатки пестицидов в продуктах - это официально разрешенное безвредное количество остатков пестицидов в пище (в мг/кг) того или иного продукта. Все приемы хранения, переработки и приготовления продуктов, как правило, способствуют уменьшению остатков пестицидов в пище. В России утверждены гигиенические нормы максимально допустимых уровней пестицидов в продуктах питания.
Поступление с пищей предельно допустимых остаточных количеств пестицидов, как правило, не приводит к острым отравлениям. Оно проявляет себя растянутым во времени хроническим действием со слабовыраженной этиологией, либо практически никак себя не проявляет. Непосредственный контакт с пестицидными препаратами, потребление продукции с высоким их содержанием могут стать причиной острых отравлений, и даже гибели людей.
По данным ООН, ежегодно почти у 1 млн. человек регистрируют отравление пестицидами, применяемыми при обработке сельскохозяйственных культур, из них около 40 тыс. человек погибают.
При этом следует отметить, что число острых отравлений, вызванных пестицидами, как правило, не превышает 10% общего числа острых отравлений. В Нидерландах, например, применяли 413 химических средств защиты растений, содержащих 221 действующее вещество. Доля вызванных ими острых отравлений, составила 10,7%. В Австрии этот показатель был равен 4%, в США - 5,3%, в России - 6,7%.
Какое же место занимают пестициды среди других веществ, представляющих опасность для жизни человека? По данным ООН общего числа отравлений химическими средствами со смертельным исходом мире на долю пестицидов приходится лишь 2,6%. Согласно той же статистке, например, обезболивающие лекарства стали причиной более многочисленных смертельных отравлений -17,4%, а алкоголь вызвал смерть в 10,5% случаев.
Таким образом, пестициды, казалось бы, нельзя отнести к химическим средствам, представляющим ощутимую реальную опасность в повседневной жизни человека. В то же время существует опасность косвенного (через трофические пищевые цепи) влияния пестицидов на здоровье человека и его наследствен аппарат. Следовательно, токсиколого-гигиенические проблемы, с которыми сталкивается человек при применении пестицидов, носят хронический характер
Третья проблема - это способность вредителей становиться устойчивыми к пестицидам: пестициды перестают их убивать. Устойчивость организма к пестициду, или резистентность, - это биологическое свойство организма сопротивляться отравляющему действию пестицида, способность выживавать, размножаться в присутствии химического вещества, которое раньше подавляло его развитие. При многократном воздействии пестицидов подавляются нормальные чувствительные формы популяции и выживают резистентные формы, которые получают преимущество и становятся доминирующей частью популяций. Выявлена резистентность и 91 вида фитопатогенов к 40 фунгицидам, у 7 видов грызунов к родентицидам, у более 50 видов сорных растений к гербицидам. Так, возбудитель пиренофороза овса обладает восьмикратной устойчивостью к этилмеркурхлориду. Обнаружены популяции колорадского жука с трехсоткратной резистентность децису, тепличной белокрылки с 100-600 кратной резистентностью к актеллику и всей группе пиретроидов.
Явлению резистентности вредных организмов присущи отрицательные факторы:
•понижение разрешающей способности пестицидов (например, эффективность пиретроидных препаратов против доминантных снизилась с 83 до 18-56%, а срок токсического действия - до 3-8 дней);
•повышение вредоносности объектов борьбы и их численности (хлопковой совки в 3 раза, колорадского жука в 5 раз, плодовых клещей в 11 раз);
•трансформация ранее отсутствующих либо второстепенных вредных организмов в доминантные. Так, обработки против клопа-черепашки на зерновых колосовых выработали резистентность у сопутствующих клопов в 15-20 раз выше, чем у основного вредителя. Все это приводит к необходимости увеличения кратности химобработок, повышению концентрации применяемых пестицидов, что в свою очередь, приводит к увеличению остаточных их количеств.
Кроме того, развитие устойчивости у насекомых поставило под угрозу успешное использование пестицидов для борьбы с насекомыми – переносчиками заболеваний. Например, комары стали восприимчивы сначала к ДДТ, а потом к пропоксуру, который заменил ДДТ. Сейчас снова наблюдается рост числа заболеваний малярией.
С четвертой проблемой столкнулись сравнительно недавно. Пестициды основное влияние оказывают на почвенную биоту, то есть живую фазу почвы. Было установлено, что почвенные микроорганизмы адаптируются к пестицидам и начинают разрушать или использовать их, или угнетаются и погибают. Выпадение отдельных таксономических групп микробисценоза характеризует направленность действия химических соединений. Из трех основных типов средств защиты растений влияние фунгицидов является максимальным, а гербицидов - минимальным.
Гербициды способны оказывать побочное действие на культуру, подавляя или активизируя развитие болезней растений. Это может быть как прямым - подавление или стимуляция фитопатогенов, так и косвенным - изменение физиологических процессов, происходящих а культурных растениях и ведущих к повышению или снижению их устойчивости к фитопатогенам. Так, внесение гербицида хлорсульфурона привело к усилению развития корневой гнили ячменя и снижению урожая почти вдвое, но не оказало никакого влияния на степень поражения растений офеоболезной гнилью.
При применении гербицидов отмечено усиление вредоносности нематод и поражение зерновых вирусной инфекцией. Последнее связано с нарушением обмена веществ в растениях. Подавляющее действие гербицидов на патогенную микрофлору семян и проростков кукурузы приводило к снижению семенной инфекции, но к увеличению пораженности кукурузы стеблевыми и корневыми гнилями. Установлено усиление степени развития некоторых заболеваний картофеля и овощных бобов при обработке диносебом и трифланом. На фоне использования атразина многие овощные культуры сильнее поражаются фузариозом, что приводит к гибели растений, а дифеномид отрицательно влияет на урожайность пасленовых овощей.
В результате пестициды становятся неэффективными в борьбе с вредными организмами, а их все увеличивающееся количество ведет к дальнейшему загрязнению окружающей среды.
6.2. ТОКСИКОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА И СУДЕБНО – ХИМИЧЕСКОЕ ЗНАЧЕНИЕ ПЕСТИЦИДОВ
Как уже было сказано ранее, пестициды проявляют высокую физиологическую активность не только в отношении вредных организмов, но многие из них обладают высокой токсичностью для людей и животных.
По сравнению с химическими веществами другого назначения пестициды имеют ряд особенностей, определяющих их опасность для человека и живой природы. Это преднамеренность их внесения в окружающую среду, непредотвратимость циркуляции в ней, возможность контакта с ними больших масс населения, высокая биологическая активность, направленная на уничтожение вредных живых объектов.
Критериями токсичности пестицидов являются величины токсических и смертельных доз при разных путях поступления в организм - через кожу, легкие или желудочно-кишечный тракт. Помимо острой токсичности пестицидов особенно большие требования предъявляются к возможным отдаленным последствиям для человека, животных и прочей биоты, так как при обработке растений 99,0-99,9% вносимых пестицидов попадают в почву, водоемы, атмосферу и в конечном результате - в сельскохозяйственное сырье.
Многие вещества, будучи малотоксичными, опасны в связи с возможностью мутагенного, тератогенного и канцерогенного действия при влиянии на организм в небольших количествах, близких к реально встречающимся. Они могут оказывать токсическое действие на плод, не принося вреда организму матери и, выделяясь с молоком, затем отрицательно влиять на рост и развитие младенца. Опасность пестицидов для человека определяют рядом критериев, характеризующих возможность поступления в организм и способность оказывать неблагоприятное воздействие.
К критериям опасности относят их устойчивость в окружающей среде, стойкость к химическим, физическим и прочим факторам.
Степень опасности при работе с пестицидами определяется величинами среднесмертельной (ЛД50) и пороговой - вызывающей минимальные нарушения - доз и концентраций при разных путях поступления в организм; зоной токсического действия (отношением ЛД50 к пороговой дозе; чем эта зона уже, тем больше опасность острого отравления), способностью проникать через неповрежденные кожные покровы и оказывать токсическое действие, наличием и выраженностью кумулятивных свойств.
Для оценки опасности пестицидов разработана их классификация по накоплению (кумуляции) их в организме (см. Классификация пестицидов п.6.3.).
6.3. КЛАССИФИКАЦИЯ ПЕСТИЦОВ
Известны несколько различных классификаций пестицидов, основанные на разных принципах. Они подразделяются на группы в зависимости от химического состава, назначения, пути проникновения в организм, степени опасности и др.
6.3.1. Классификация по химическому составу:
ü неорганические
ü органические
А. Неорганические пестициды
1. Соединения меди (в основном, инсектофунгициды)
• СиS04-5Н2О - медный купорос
• З Са(ОН)2 • СиSО4 - бордосcкая жидкость
• СиSО4 • Си(ОН)2 • СиСОз - препарат АБ
2. Соединения мышьяка (кишечные инсектициды, зооциды, консерванты)
• Аs2Oз - мышьяковистый ангидрид
•Са(АsO2)2 - кальция арсенит
•Си(СН3СОО)2 • ЗСи(AsO2)2 - парижская (швейнфуртская) зелень
3.Соединения фосфора (зооциды)
• Zn3Р2 - цинка фосфид
4.Соли галогенсодержащих кислот
• NаСlOз, КСlOз - натрия и калия хлораты (гербициды сплошного действия)
• Мg(СlOз)2, Са(СlOз)2 - магния и кальция хлораты (дефолианты)
•NaF, Н2SiF6 - натрия фторид и кислота кремнефтороводородная (антисептики, инсектициды, зооциды)
5. Сера и полисульфиды Са, Ва (акарициды, фунгициды)
6. Серная кислота и ее соединения (гербициды сплошного действия,
дефолианты, десиканты)
Б. Органические пестициды
1.Хлорорганические пестициды (ХОП)
1.1. группа ДДТ (инсектициды)
1.2. группа гексахлорциклогексана (инсектициды)
1.3.группа полихлорциклодиенов (инсектициды и стимуляторы роста растений)
2. Производные фенолов (инсектициды, фунгициды, гербициды, бактерициды)
3. Производные кислоты карбаминовой кислоты (гербициды)
4. Производные арилоксикарбоновой кислоты
5. Фосфорорганические соединения – эфиры фосфорных кислот
5.1. Эфиры тиофосфорной кислоты (метафос, тиофос)
5.2.Эфиры дитиофосфорной кислоты (карбафос, фталафос)
5.3. Амиды пирофосфорной кислоты (оксаметил)
5.4. Эфиры фосфоновой кислоты (хлорофос)
5.5. Эфиры фосфорной кислоты (дихлофос)
6. Органические соединения ртути
C2H5HgCl – этилмеркурхлорид (протравливатель семян)
7. Пиретроиды –производные циклопропанкарбоновых кислот
8. Триазиновые производные (атразин, симазин)
9. Природные пестициды (инсектофунгициды)
6.3.2. Классификация по назначению (по объектам применения):
• акарициды - для борьбе с растительноядными клещами;
•альгициды - для уничтожения водорослей и другой сорной растительности в водоемах;
• антигельминты - для борьбы с паразитическими червями у животных;
•антирезистенты - специальные добавки, снижающие устойчивость насекомых к отдельным веществам;
• антисептики - для предохранения деревянных и других неметаллических материалов от разрушения микроорганизмами;
• арборициды - для уничтожения нежелательной древесной и кустарниковой растительности;
• аттрактанты - для привлечения насекомых;
• афициды - для борьбы с тлями;
• бактерициды - для борьбы с бактериями и бактериальными болезнями растений;
• гаметоциды - вещества, вызывающа стерильность культурных растений и сорняков;
• гербициды - для борьбы с сорными растениями;
• десиканты - для предуборочного подсушивания растений;
• дефолианты - для удаления листьев;
• зооциды или родентициды - для борьбы с грызунами.
• инсектициды - для борьбы с вредными насекомыми,
• инсектоакарициды - для борьбы одновременно с вредными насекомыми и клещами;
• лаврициды - для уничтожения личинок и гусениц насекомых;
• лимациды или моллюскониды - для борьбы с различными моллюсками, в том числе юрюхоногими;
• нематоциды - для борьбы с круглыми червями (нематодами);
• овициды - для уничтожения яиц вредных насекомых и клещей:
• протравители семян - для предпосевной обработки семян;
•регуляторы роста растений - вещества, влияющие на рост и развитие растений;
• репелленты - для отпугивания вредных насекомых;
• ретарданты - для торможения роста растений;
• синергисты - добавки, вызывающие усиление действия пестицидов;
• феромоны - вещества, продуцируемые насекомыми для воздействия на особей другого пола;
• фумиганты - вещества, применяемые в паро- и газообразном состоянии для уничтожения вредителей и возбудителей болезней растений;
• фунгициды - для борьбы с грибковыми болезнями растений, вызываемых различными грибками;
• хемостерилизаторы - для химической половой стерилизации насекомых.
Классификация по назначению (объектам применения), в известной степени условна, так как многие пестициды обладают универсальностью действия и поражают как насекомых - имаго, так и личинок и клещей, а некоторые гербициды при увеличении доз могут уничтожать древесно-кустарниковую растительность.
6.3.3. Классификация в зависимости от путей проникновения в организм
насекомых:
- Контактные - убивающие насекомых при соприкосновении с любой частью тела
-Кишечные - проникающие в организм через ЖКТ
-Системные - делающие растения на определенный срок ядовитыми и «пищу» убивающие насекомых
- Фумиганты - проникающие через дыхательные пути.
6.3.4. Классификация по накоплению (кумуляции) их в организме
В основе использован коэффициент кумуляции К, представляющий собой отношение суммарной дозы, вызывающей гибель животных при повторном воздействии, к ЛД50 при однократном введении; чем меньше К, тем опаснее вещество.
Таблица 2. «Классификация пестицидов по накоплению (кумуляции) их в организме»
| Показатель | Классы | |||
| Чрезвычайно опасные Менее 50 | Опасные 51-200 | Умеренно Опасные 201-1000 | Малоопасные Более 1000 | |
| Средняя смертельная доза при введении в желудок мг/кг | Менее 100 | 101 -500 | 201-1000 | Более1000 |
| Средняя смертельная доза при нанесении на кожу мг/кг | Менее 500 | 501-2000 | 2001 -20000 | Более 20000 |
| Средняя смертельная концентрация в воздухе мг/м3 | Менее 1 | 1-3 | 3,1 -5 | Более 5 |
| Коэффициент кумуляции (1/10 ЛД50, 2 мес) | Время Разложения на нетоксичные компоненты более 1 года | Время Разложения на нетоксичные компоненты 6-12 мес | Время Разложения на нетоксичные компоненты 1-6 мес | Время Разложения на нетоксичные компоненты 1 мес |
| Стойкость в почве |
6.3.5. Существуют также гигиенические классификации пестицидов по следующим признакам:
- по бластомогенности
- по тератогенности
- по эмбриотоксичности
- по аллергенным свойствам.
6.3.6. Характеристика пестицидов зависимости от характера действия:
1. Контактного действия - действуют только на те участки растений, куда попали (органические соединения ртути, цианиды, кислота серь медный купорос).
2. Системного действия - проникают в сосудистую систему и передвигаются по всему растению (натрия арсенат, 2,4-дихлорфеноксиуксусная кислота).
3. Гербициды, действующие на корневую систему растений или прорастающие семена (карбаматы, хлорпикрин).
Существует также деление гербицидов на препараты:
• сплошного действия - действующие на все растения
• избирательного (селективного) действия - опасные для одних видов растений и безопасные для других
6.3.7. Классификация по формам применения пестицидов:
1. Дусты (порошки) - смесь пестицидов с инертными наполнителями, размолотыми до размеров 3-30 мкм. В таком виде выпускаются инсектициды, акарициды, фунгициды, гербициды. Используют для опыливания и опудривания.
2. Гранулы - более удобны в применении, чем порошки, не пылят, легко удаляются с кожи и одежды человека. Применимы для фунгицидов, инсектицидов. В состав гранулированных препаратов входят от 0,5 до 20% пестицида. Применяют для обработки растений и внесения в почву.
3. Микрокапсулы - действующее вещество заключено в оболочку (капсулу), легко разрушается под влиянием различных факторов, размер - 5-100 мкм.
4. Растворы в воде и органических растворителях
Водные растворы применяются для пестицидов, хорошо растворимых в воде (производные карбоновых, сульфоновых кислот, фенолов). Эффективно протравливание семян водными растворами фунгицидов.
Растворы в органических растворителях — используются для ультра- и малообъемного опрыскивания.
5. Смачивающиеся порошки - порошкообразные препараты, при разбавлении которых образуются достаточно устойчивые суспензии:
а) с высоким содержанием пестицидов (60-90%);
б) со средним содержанием пестицидов (30-60%);
в) с малым содержанием пестицидов (5-30%). Используют для опрыскивания.
6. Текучие смачивающиеся порошки - образуются при разбавлении водой, представляют смесь эмульсии и суспензии. Чаще всего используются для гербицидов.
7. Концентраты эмульсий - образуют стойкие эмульсии. Применяются для дезинфекционных препаратов, антисептиков, инсектицидов. Используют для опрыскивания.
8. Аэрозоли - используются для опрыскивания
9. Другие формы применения - антисептические и инсектицидные мыла, краски, лаки, мази, мастики, воска, инсектицидные карандаши, инсектицидная и бактерицидная бумага, различные приманки и т.д.
6.4. ОСНОВНЫЕ ГРУППЫ ПЕСТИЦИДОВ
6.4.1. Хлорорганические пестициды (ХОП) применяют в сельском хозяйстве в качестве активных инсектицидов, акарицидов и фумигантов в борьбе с вредителями зерновых и технических культур. По химической природе пестициды этого класса представляют собой хлорпроизводные ароматических углеводородов циклопарафинов, терпенов. К ним относятся гексахлорбензол, гексахлорбутадиен - изомер ГХЦГ, ДДТ, ДДЦ, дилор, кельтан, метоксихлор и др. Они могут длительно (до 1,5 -10 лет и более) сохраняться в почве, воздействовать на почвенную фауну и переходить в произрастающие растения. Из-за высокой устойчивости в окружающей среде и способности к биоконцентрации ХОП превратились глобальные загрязнители. Им присущи сверхвыраженная кумуляция. Большинство ХОП плохо растворимы в воде, но хорошо - в органических растворителях, в том числе - жирах.
Изолирование ХОП основано на экстракции пестицида из измельченного объекта органическим растворителем (н-гексан), для ГХЦГ возможна перегонка с водяным паром. Качественный и количественный анализ сводится, в большинстве случаев к отщеплению одного или нескольких атомов хлора и последующему обнаружению хлоридов и ароматического ядра методами ТСХ и ГЖХ с электронозахватным детектором (ДЭЗ).
Метаболизм хлорированных ароматических углеводородов - гексахлорбензола, ДДТ и его аналогов во внешней среде и различных биологических протекает по восстановительному и дегидрохлорированному механизмам. Общепризнан ряд возможных путей метаболизма ДДТ в живых тканях: окисление до ДДА (дихлордифенилуксусная кислота); дегидрохлорирование до ДДЭ (2,4-дихлорэтилен); восстановительное дехлорирование до ДДЦ (2,4-дихлордифенилдихлорметилметан).
ДЦД - активный контактный инсектицид, лишь несколько уступающий ДДТ по токсичности. Для теплокровных особенно опасна его высокая хроническая токсичность.
Реакция дегидрохлорирования свойственна также и другой группе, например, продуктам хлорирования циклопарафинов, к которым относится гексахлорцикпогексан (ГХЦГ). Под влиянием микроорганизмов превращается в пентахлорциклогексан, переходящий затем в трихлорбензол, который, в свою очередь, взаимодействует с сульфгидрильными группами аминокислот.
ХОП обладают эмбриотоксическим действием, вызывают пороки развития и мутагенные изменения. Некоторые являются канцерогенами и аллергенами, что явилось основанием для ограничения, либо запрещения их применения в отдельных регионах России.
6.4.2. Пестициды из класса фенолов. Фенолы проявляют широкий диапазон физиологического действия и являются фунгицидами, бактерицидами, инсектицидами и гербицидами. Причем пестицидная активность фенолов возрастает при введении в ароматический радикал различных заместителей, особенно нитрогруппы. Из многочисленных производных динитропроизводных фенолов практическое значение приобрели ДИНОК и ДИНОСЕБ.
По физическим свойствам оба препарата представляют собой желтые кристаллические вещества. Изолирование при ХТА из внутренних органов трупа, крови, мочи возможно как подщелоченной, так и подкисленной водой, очистка - хроматографией в тонком слое силикагеля. Качественное обнаружение проводят по реакции с раствором натрия гидроксида - появляется желтое окрашивание, либо с использованием других реакций, характерных для фенолов. Количественное определение проводят спектрофотометрическим методом в УФ- области, максимум поглощения наблюдается при длине волны = 370 нм.
Производные карбаминовых кислот - карбаминаты (эфиры карбаминовой кислоты). Наиболее широкое применение нашел севин. Изолирование при ХТА из внутренних органов трупа производится повторной экстракцией бензолом. Качественное обнаружение основывается на предварительном гидролизе севина до нафтола и последующем его доказательстве следующими реакциями:
1.С купробромидом натрия после нагревания появляется фиолетовое окрашивание.
2. С 4-аминоантипирином - оранжево-красное окрашивание.
3.С 0,5% раствором NaNO2 в кислоте серной разбавленной появляется желтое окрашивание, переходящее в оранжевое при создании щелочной среды.
Количественное определение севина проводят ФЭК методом после его щелочного гидролиза до нафтола и последующем вовлечении последнего в реакцию с купробромидом натрия.
6.4.3. Фосфорорганические пестициды (ФОП). Одна из наиболее распространенных и многочисленных групп пестицидов. К ним относятся афуган, актеллик, дибром, карбофос, бромофос. фталофос, хлорофос, цидиал и др.
Большинство ФОП обладают высокой летучестью, слаборастворимы в воде, хорошо - в органических растворителях. По стойкости в окружающей среде значительно уступают ХОП. Однако некоторые из них сохраняют свои токсические свойства в почве и на растениях в течение нескольких месяцев и более, в результате чего возможно их поступление в организм человека с продуктами питания, воздухом и водой. Способны проникать через неповрежденную кожу, различные биологические мембраны и гематоэнцефалический барьер. Установлено, что в течение 11 недель 30% немакура, внесенного в почву, поглощается растениями. Более устойчивы остаточные количества ФОП в плодах цитрусовых. Это объясняется их растворением в маслах кожуры плодов.
Хотя ФОП не накапливаются в организме так интенсивно, как ХОП, они все же обладают кумулятивными свойствами в результате суммирования токсических эффектов - функциональной кумуляцией.
В клинической практике наиболее часто встречаются острые отравления карбофосом, хлорофосом, метафосом. Летальная доза для человека при приеме рег оs составляет для метафоса 0,2-2 г, для карбофоса, хлорофоса - 5-10 г.
Токсическое действие ФОП связано с угнетением активности холинэстеразы (ХЭ). При взаимодействии ХЭ с ФОП образуется устойчивый к гидролизу, либо способный к нему (в случае воздействия, например, зорина) фосфорилированный фермент, не способный регулировать процессы разложения ацетилхолина в синапсах. В результате накопления ацетилхолина наблюдаются характерные изменения в ЦНС и вегетативной нервной системе, проявляющиеся головной болью, ухудшением памяти, нарушением сна, дезориентацией в пространстве, бронхоспазмами, судорогами, угнетением дыхания. Для некоторых характерны невриты, парезы, параличи.
В организме метаболизм ФОП протекает по пути окисления (с потерей радикалов), десульфирования и дехлорирования. При этом могут образовываться более токсичные соединения.
К осложнениям, развивающимся при тяжелых отравлениях ФОП, относя пневмонии, поздние интоксикационные психозы и полиневрозы, возникающие через несколько дней с момента отравления.
Достоверно установлены генетические нарушения (повышение эмбриональной смертности и врожденных аномалий у потомства) у лиц, перенесших острые отравления ФОП, и у рабочих промышленных предприятий, подвергающихся хроническому воздействию низких концентраций этих веществ.
Химико-токсикологический анализ ФОП имеет чрезвычайно важное значение для доказательства ФОП, т.к. они, в большинстве случаев, не вызывают каких-либо специфических морфологических изменений в организме человека.
ХТА представляет большую сложность ввиду большого ассортимента быстрого метаболизма в организме и образования новых продуктов, а также изолировании и обнаружении.
6.4.4. Ртутьорганические пестициды (РОП). Относятся к сильнодействующим ядовитым веществами или высокотоксичным препаратам для теплокровных животных и человека. Их применяют ограниченно - только для обработки семян в борьбе с бактериальными и грибковыми заболеваниями.
В некоторых странах, например, в России, Германии и Японии, применение их запрещено. Опасность РОП для людей связана не только с их высокой токсичностью, но и с летучестью, вследствие которой пары ртути образуются при комнатной и более низкой температуре, что может привести к тяжелые отравлениям.
В окружающей среде РОП трансформируются: одним из конечных продукту этих превращений является метилртуть. При хроническом отравлении наблюдается потеря веса, слабость, утомляемость, психические расстройства, зрительные и слуховые галлюцинации, стоматит. Более подробная информация о РОП расположена в разделе «Металлические яды».
6.4.5. Арилоксиалкилкарбоновые кислоты и их производные (ААКК). Широко используют в качестве гербицидов, альгицидов, регуляторов роста растений. наибольшее распространение получили 2,4-дихлорфеноксиуксусная кислота (2,4-Д) и ее производные, 2,4-дихлорфеноксипропановая кислота (2,4-ДП) и ее производные.
Многие промышленные гербициды представляют собой не свободные ААКК, а их соли с металлами или аминами или эфиры. Последние являются более сильными гербицидами, чем соли. Из большого числа эфиров 2,4-Д практическое применение нашли низколетучие этиловый, бутиловый, амиловый, гептиловый, октиловый.
Большинство гербицидов группы ААКК среднетоксичны, их ЛД50 для крыс находится в пределах 375 - 100 мг/кг. Действие этих пестицидов на качество воды проявляется главным образом в ухудшении ее вкуса и запаха, связанном с присутствием фенолов.
6.5. ИЗОЛИРОВАНИЕ, ОБНАРУЖЕНИЕ И ОПРЕДЕЛЕНИЕ ПЕСТИЦИДОВ
Изолирование пестицидов, в большинстве случаев, осуществляют экстракцией различными органическими растворителями: пентан, гептан, петролейный эфир, хлороформ, четыреххлористый углерод и др. В некоторых случаях используют полярные растворители, например, для изолирования производных арилоксикарбоновых кислот. Также возможна перегонка с водяным паром (ртутьорганические соединения, никотин, анабазин).
Единого универсального метода изолирования пестицидов, так же как и общей схемы очистки полученных экстрактов, не существует.
Рекомендуются методы изолирования пестицидов для каждого конкретного объекта исследования (воздух, пищевые продукты растительного происхождения, почва, кровь, моча и т п.) и конкретного препарата.
Методы очистки пестицидов, выделенных из биологических объектов, разнообразны. Имеет место очистка перегонкой с водяным паром, экстрам кристаллизацией, хроматография в тонких слоях сорбента.
Качественный анализ и количественное определение пестицидов проводятся по нативному веществу, либо по метаболитам, которые обнаруживают, используя хроматографические и биохимические методы анализа.
При рассмотри отдельных групп и представителей пестицидных препаратов будут приведены подходы к проведению химико-токсикологического анализа.
Объектами исследования при ХТА могут быть как сами ядохимикаты, биологические объекты - желудок с содержимым, печень, почки в смертельных случаях отравления и биологические жидкости - кровь, моча - у живых лиц при установлении диагноза острого отравления, а при санитарно-гигиенических исследованиях - пищевые продукты, почва, вода.
Изолирование из внутренних органов трупа основано на настаивании измельченных органов с 3-х кратным объемом смеси: ацетон-этанол-хлороформ (1,5:1,5:1) при рН 5-5,5 в течение 4 часов с последующим экстрагированием хлороформом.
Изолирование из биологических жидкостей проводят при рН 5 экстракцией хлороформом с последующей концентрацией извлечения.
6.5.1.Тонкослойная хроматография в анализе ФОП - второй по значимости метод. По сравнению с методом ГЖХ он менее чувствителен и специфичен, не дает точной количественной оценки, но преимущество его в том, что он не требует специальной аппаратуры и, при необходимости, может быть использован в лаборатории.
Метод ТСХ используется для очистки и разделения ФОП, идентификации ориентировочного количественного определения.
Для хроматографирования используют пластины «Silufol», либо стеклянные пластины с силикагелем, фиксированным гипсом. Хроматограммы развивают в одной из систем растворителей: 1. гексан-ацетон-бензол 4:1; 2.
Общая проба на ФОП
На пластину наносят 2 точки метчика с содержанием смеси ФОП 10 и 20 мкг (для ориентировочного количественного определения) и аликвоту извлечения. Хроматографируют в одной из систем, затем проявляют, последовательно обрабатывая пластину.
1. Парами брома - наблюдают буро-коричневые пятна (не специфична, дают соэкстрактивные вещества);
2. Спиртовым раствором железа (III) хлорида и кислоты сульфосалициловой наблюдают пятна желтого или белого цвета (фосфат-ион). При положительном результате общей пробы на ФОП устанавливают класс ФОП.
Определение класса ФОП
На три хроматографические пластины наносят аликвоты экстрактов, как в общей пробе. После хроматографирования пластины обрабатывают следующим образом: 1-ю пластину (на серусодержащие ФОП) с палладия хлоридом, наблюдают пятно желтого цвета, либо с серебра нитратом и бромфеноловым синим, при этом наблюдают пятно лилового цвета (после обесцвечивания фона кислотой лимонной).
2-ю пластину (на ФОП с нитрофенильным радикалом) опрыскивают спиртовым раствором едкого натрия. При наличии в пятне свободных нитрофенолов (метаболиты) - желтая окраска появляется сразу, в присутствии ФОП с нитрофенильным радикалом - желтая окраска появляется после нагревания. 3-ю пластину (на хлорофос и дихлофос) обрабатывают щелочным раствором резорцина, наблюдают пятна, окрашенные в розовый цвет.
Пятна, выявленные ее всех случаях, сравнивают с пятнами метчика. При совпадении Rf искомого ФОП с Rf метчика выполняют подтверждающие реакции и проводят ориентировочное количественное определение по площади пятна. Содержание ФОП рассчитывают по формуле:
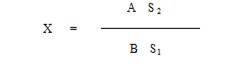
где X - содержание ФОП в объекте (мкг/кг)
А - содержание ФОП в стандарте (мкг)
В - навеска пробы в г с учетом аликвоты
S1 - площадь пятна медика (мм2)
S2 - площадь пятна пробы(мм2)
При положительном результате общей пробы на ФОП определяют степень угнетения холинэстеразы крови.
6.5.2. Холинэстеразная проба (энзимное экспозиционно-колориметрическое определение) - основана из способности ФОП угнетать активность фермента холинэстеразы. При угнетении холинэстеразы нарушается регулирование разложения ацетинхолина, что приводит к его накоплению и непрерывному раздражению нервных клеток. Как следствие, нарушаются функции ЦНС и вегетативной НС. Это приводит к тяжелейшим расстройствам - судорогам, параличам, бронхоспазму, угнетению дыхания и сердечной деятельности.
В норме ацетилхолин под влиянием фермента холинэстеразы разрушается с образованием холина и уксусной кислоты, в результате чего изменяется рН смеси ацетилхолин + холинэстераза.
Изменение рН можно зафиксировать с помощью кислотно-основных индикаторов, например, бромтимолового синего. Изменение окраски в контроле (от синей к желтой) происходит в течение 10-15 минут. В присутствии ФОП (как антихолинэстеразных веществ) окраска индикатора не изменяется более продолжительное время, чем в контроле.
Угнетение активности холинэстеразы рассчитывают в % по формуле:
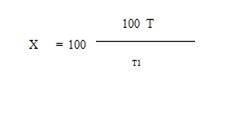
где Т - время изменения окраски в контрольной пробе;
Т1 время изменения окраски в исследуемой пробе.
Угнетение активности холинэстеразы более чем на 10 % указывает возможное присутствие в пробе ФОП.
Экстрактивные вещества органов трупа, крови, мочи без глубокого гнилостного разложения не мешают определению. Продукты гниения могут снижать активность холинэстеразы на 10-50 %. В этом случае проводят предварительную очистку пробы на колонке с активированным углем.
Холинэстеразная проба неспецифична, используется как предварительный ориентировочный тест, не имеющий отрицательного судебно-химического значения.
6.5.3.Метод газожидкостной хроматографии (ГЖХ) в анализе ФОП
ГЖХ - наиболее современный метод, практически вытеснивший традиционные аналитические методы вследствие высокой чувствительности селективности, экспрессности и возможности сочетания качественного количественного анализа в одной пробе без предварительного изолирования очистки.
Остаток, полученный после отгонки растворителя, подвергают исследованию на газовом хроматографе с термоионным детектором, который наиболее чувствителен к соединениям, содержащим фосфор. Принцип действия термоионного детектора заключается в том, что соли щелочных металлов, испаряясь в пламени горелки, селективно реагируют с соединениями, содержащими галогены и фосфор, в результате чего в ионизационной камере появляется ионный ток.
Подвижная фаза - азот, в качестве неподвижной фазы используются различные ВМС (под марками 5Е-30, ОУ-17, ХЕ-60), обладающие различной полярностью, что позволяет повысить селективность метода и эффективно разделить большое число ФОП. Граница определения составляет от 0,001 0,0001 г/л, что делает возможным обнаружение следовых количеств ФОП.
Следует отметить, что анализ на содержание ФОП необходимо проводить возможно быстрее (не позднее 2-х часов после взятия крови). При оценке результатов важно учитывать снижение концентрации ФОП в крови при хранении.
7. «ХИМИКО - ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗ ВЕЩЕСТВ, ИЗОЛИРУЕМЫХ ИЗ ОБЪЕКТА НАСТАИВАНИЕМ С ВОДОЙ, С ПОСЛЕДУЮЩИМ ДИАЛИЗОМ А ТАКЖЕ ТРЕБУЮЩИХ ИЛИ НЕТРЕБУЮЩИХ ОСОБЫХ МЕТОДОВ ИЗОЛИРОВАНИЯ»
В данной главе рассмотрен химико-токсикологический анализ веществ, изолируемых экстракцией водой в сочетании с диализом; дана общая характеристика группы. Показана распространенность отравлений, их причины; клиника отравлений и клиническая диагностика; обозначены объекты исследования.
Определены особенности химико-токсикологического анализа кислот (серной, азотной, соляной), щелочей (гидроксиды натрия, калия и аммония), нитратов и нитритов.
Рассмотрен химико-токсикологический анализ веществ, требующих особых методов изолирования (соединения фтора).
Из группы веществ, не требующих особых методов изолирования, рассмотрен оксид углерода. Показана распространенность отравлений, причины; токсичность; классификация отравлений по степени тяжести. Механизм токсического действия. Токсикокинетика (всасывание, распределение, выведение из организма).
Рассмотрены объекты исследования, правила отбора пробы, качественный и количественный анализ. Даны химические экспресс-методы обнаружения в крови карбоксигемоглобина, количественное определение карбоксигемоглобина в крови.
7.1. ГРУППА ТОКСИКОЛОГИЧЕСКИ ВАЖНЫХ ВЕЩЕСТВ,
ИЗОЛИРУЕМЫХ ЭКСТРАКЦИЕЙ ВОДОЙ С ПОСЛЕДУЮЩИМ ДИАЛИЗОМ (МИНЕРАЛЬНЫЕ КИСЛОТЫ, ЩЁЛОЧИ И ИХ СОЛИ)
К группе веществ, изолируемых экстракцией водой (с помощью диализа), относятся минеральные кислоты: серная, азотная и хлористоводородная; щелочи (гидроксиды калия, натрия), гидроксид аммония; и некоторые соли, имеющие токсикологическое значение: нитрит натрия (реже калия), нитраты натрия и аммония (реже калия).
Исследование на данную группу веществ проводится в том случае, если материалы дела указывают на отравление этими веществами.
В случае перехода кислот в соли, а щелочей в углекислые соли их обнаружение невозможно, так как эти соединения являются составными частями организма.
Минеральные кислоты и щелочи широко применяются в народном хозяйстве и легко доступны. Известны случаи умышленных отравлений и самоотравлений кислотами, преступного вредительства, обливания кислотой серной. Кислоты также могут вызвать профессиональные отравления. Пары кислоты серной содержатся в воздухе помещений, где её производят, а газообразный серный ангидрид с влагой воздуха образует серную кислоту. Кислота азотная имеет значение профессионального яда вследствие образования окислов азота при её изготовлении, а также вследствие широкого применения для растворения и травления металлов. Пары хлористого водорода в воздухе рабочих помещений могут вызвать отравление.
Смертельная доза при приёме внутрь концентрированной кислоты серной -5г, концентрированной кислоты азотной - 8г, кислоты соляной -15г.
Известны случаи отравления селитрами (KNO3, NaNО3) при смешении их с другими солями (например, с натрия хлоридом или вместо натрия хлорида использовались в пищу) и при большом их приёме (доза около 5г считается ядовитой, а приём 9г является смертельной).
На первом месте по частоте отравлений среди щелочей стоит едкий натр (каустическая сода). Довольно часто наблюдаются случаи отравлений и самоотравлений водным раствором аммиака (нашатырный спирт) и при вдыхании, газообразного аммиака в воздухе рабочих помещений.
Объектами исследования являются содержимое желудка, рвотные массы, остатки пищи, части одежды, а при исследовании на соли ещё печень.
Внешний вид объектов исследования может указывать на отравление той или иной кислотой. При отравлении концентрированной кислотой серной происходит сильное повреждение тканей губ, языка, пищевода, желудка, одежды. Характерным признаком концентрированной кислоты серной является обугливание углеводов.
Концентрированная кислота азотная поражает ткани языка, пищевода, слизистой желудка. Кожа лица становится желтушной. Если концентрация кислоты азотной менее 20% жёлтой окраски может не быть. Свободная кислота азотная при достаточной концентрации фиксируется на белковых объектах, окрашивая их в жёлтый цвет, переходящий от аммиака в оранжевый (ксантопротеиновая реакция). Открытие иона хлора серебром азотнокислым (обильное выпадение осадка) при наличии свободной минеральной кислоты делает необходимым испытание на свободную соляную кислоту.
Реакция среды исследуемых жидкостей может дать ясные указания на отравление тем или иным веществом.
Для доказательства минеральных кислот используют кислотно-основные индикаторы: лакмус, метиловый оранжевый, метиловый фиолетовый, конго красный и другие. Кислая реакция на лакмус может обусловливаться наличием свободных кислот, кислых солей сильных кислот и солей тяжёлых металлов. Кислая реакция содержимого желудка уже исключает возможность открытия введённых в организм едких щелочей. Содержимое желудка и ткани внутренностей имеют кислую реакцию на лакмус не вследствие их первоначальной кислотности (соляная кислота желудочного сока уже не открывается в трупе), а как результат кислотного брожения, вызываемого бактериями. С переменой бактерийной флоры начинается щелочное брожение, образуются аммиак и сероводород, содержимое желудка приобретает щелочную реакцию на лакмус. При этом часто успевают нейтрализоваться до исследования даже введённые внутрь кислоты, что делает невозможным их открытие.
Ярко выраженная кислая реакция среды не является окончательным доказательством присутствия минеральных кислот.
Щелочная реакция на лакмус может обусловливаться наличием едких щелочей и их углекислых солей. Для их отличия используют фенолфталеин. Несколько капель испытуемой жидкости смешивают с одной - двумя каплями спиртового раствора фенолфталеина и взбалтывают с избытком бария хлорида. Если присутствует едкая щёлочь, розовая окраска фенолфталеина не исчезает, а присутствие углекислых солей приводит к обесцвечиванию раствора.
2NaOH + ВаС12 = 2NaCI +Ва(ОН)2
Ва(ОН)2 = Ва2+ + 2ОН-
Na2CО3 + NaCI2 = 2NaCI + ВаСОз
Изолирование. Объект смешивают с небольшим количеством дистиллированной воды до густой кашицы (способной фильтроваться) и фильтруют через 1-2 часа. Для увеличения скорости фильтрования используют водоструйный насос. Смесь до фильтрования или фильтрат для отделения белковых веществ подвергают диализу.
Диализ - разделение растворённых веществ, различающихся молекулярными массами. Процесс основан на неодинаковых скоростях диффузии этих веществ через проницаемую мембрану, разделяющую концентрированные и разбавленные растворы. Под действием градиента концентрации растворённые вещества с разными скоростями диффундируют через мембрану в сторону разбавленного раствора. Скорость переноса веществ в обратном направлении снижается вследствие диффузии растворителя (обычно вода). Для диализа используют нитро и ацетилцеллюлозные мембраны. Мембраны - это разделительные перегородки. Разделение с помощью мембран - результат конкурирующих взаимодействий компонентов смеси с поверхностью перегородки. В пограничном слое около поверхности перегородки накапливается вещество, имеющее наименьшую скорость проницания.
Кроме диализа для этих целей используют электродиализ. Электродиализ - метод разделения растворов под действием электродвижущей силы, которая создаётся по обе стороны полимерных перегородок Электродиализаторы состоят из ряда камер, по которым перемещаются растворы электролитов. Они широко используются для обессоливания растворов.
Диализ объекта проводят 2-3 раза по 4- 6 часов. Полученные диализаты выпаривают на водяной бане до объёма 5-10 мл и исследуют на наличие кислот, щелочей и солей. При исследовании одежды и некоторых других объектов могут быть использованы вытяжки без диализа.
Минеральные кислоты. При ярко выраженной кислой реакции диализата проводят исследование на наличие анионов кислот. Обнаружение анионов серной, азотной и соляной кислот не является доказательством отравления кислотами, так как эти анионы могут быть в организме как составная часть органов и тканей. Для доказательства кислот необходимо отогнать их из диализата и исследовать отгон на наличие свободных кислот, соли этих кислот при этом не отгоняются.
Едкие щёлочи. Доказательством отравления едкими щелочами является ярко выраженная щелочная реакция диализата (рН 8-10, индикатор фенолфталеин). При гидролизе карбонатов щелочных металлов также могут образоваться щелочи, поэтому вытяжку необходимо проверить на наличие карбонатов (см. выше).
Предварительной пробой на аммиак является посинение красной лакмусовой бумажки от паров вытяжки. Обнаружение аммиака в биологическом материале может говорить не только об отравлении им, но и об образовании аммиака при гниении трупного материала. При гниении трупного материала кроме аммиака образуется сероводород. Почернение бумажки, пропитанной щелочным раствором уксуснокислого свинца, указывает на наличие сероводорода и на процессы гниения исследуемых объектов, что делает невозможным открытие введённого аммиака.
Соли. Наличие нитритов в диализате доказывают при помощи реакций диазотирования с ароматическими аминами.
7.2. ГРУППА ТОКСИКОЛОГИЧЕСКИ ВАЖНЫХ ВЕЩЕСТВ, ТРЕБУЮЩИХ ОСОБЫХ МЕТОДОВ ИЗОЛИРОВАНИЯ (СОЕДИНЕНИЯ ФТОРА)
К этой группе веществ относятся соли фтористоводородной (плавиковой) кислоты: NaF, NH4F, LiF, CaF2, BaF2, PbF2, CuF2.2H2О, NH4HF2, CrF3, NasAIFe (3NaF.AIF3) и другие, а также соли кремнефтористоводородной кислоты: Na2SiF6, K2SiF6, CaSiF6 2H2О, BaSiF6 и другие. Данные соли применяются в промышленности, сталеварении, стекловарении, в качестве консерванта древесины, в сельском, хозяйстве в качестве инсектицидов. Отравления соединениями фтора обусловлены их ошибочным применением в быту вместо других солей. Токсическая доза для человека 0,012г; смертельная - 10г.
Клиника и патологоанатомическая картина отравлений фторидами нехарактерна, наблюдаются лишь местные воспалительные явления. Поэтому диагностика отравлений ими затруднительна.
Токсическое действие объясняется поражением некоторых ферментных систем и обмена веществ, особенно углеводного и солевого. При остром отравлении происходит поражение центральной нервной системы и желудочно-кишечного тракта, а при хроническом происходит изменение в зубах и костях (флюороз).
Фториды поступают в организм через желудочно-кишечный тракт, где кислая реакция желудочного сока способствует переходу нерастворимых соединений фтора в более растворимые, что улучшает их всасываемость. В организме фтор вытесняет йод из некоторых его органических соединений, а также образует комплексные соединения с рядом микроэлементов. Наибольшая концентрация фтора обнаруживается в железах внутренней секреции, костях и зубах.
Выделение фтора из организма осуществляется почками, желудочно-кишечным трактом и потовыми железами. В моче фтор появляется через 30 минут после введения Bt желудок, достигая максимума выделения на 1-5 день. За три недели с мочой выделяется до 55% введённой дозы.
Объектами исследования являются моча, содержимое желудка, внутренние органы и пищевые продукты.
Изолирование. Измельчённый объект в количестве 25 г подщелачивают избытком едкой извести, смачивают раствором аммония нитрата или концентрированной кислотой азотной, высушивают и прокаливают при температуре не выше 500°С до полного сжигания. Параллельно делают слепой опыт.
Качественное обнаружение. Большинство методов открытия фтора основано на травлении стекла. Принцип таких методов заключается в разрушении силикатной основы стекла фтористым водородом с образованием летучего SiF4:
SiО2 + 4HF = SiF4 + 2H2О
1. Часть остатка в платиновом (или свинцовом) тигле смачивают несколькими каплями воды и небольшим количеством концентрированной кислоты серной. Тигель быстро закрывают часовым стеклом, низ которого покрыт воском и на поверхности воска сделана какая-нибудь надпись при помощи острия иглы. Пробу оставляют на сутки и наблюдают травление стекла в тех местах, где была сделана надпись за счёт выделения фтористого водорода. Скорость травления стекла можно увеличить при нагревании, но в этом случае вместо воска нужно использовать специальный лак.
2. Часть полученной золы после изолирования смешивают в пробирке с песком (SiО2) и добавляют немного концентрированной кислоты серной. У отверстия пробирки держат стеклянную палочку с капелькой воды. При наличии утора выделяется SiF4, что "приводит к помутнению капельки воды на кончике стеклянной палочки за счёт образования кремниевой кислоты.
3SiF4 + 4Н2О = H2SiО4 + 4Н+ + 2[SiF6]2-
3. В пробирку с нагретой концентрированной кислотой помещают кристаллик калия бихромата и вносят испытуемую пробу (2-3 капли раствора или 5-10 мг порошка). Смесь нагревают и при наличии фтора наблюдают не смачиваемые места на стекле пробирки, от которых отстаёт тонкая плёнка хромовой смеси. Анализу мешают борная и кремниевая кислоты.
3. Капельная реакция. На фильтровальную бумагу, пропитанную цирконализариновым лаком, который имеет красную окраску, наносят водный раствор исследуемого вещества. При наличии фтора красная окраска исчезает, появляется жёлтое окрашивание.
7.3. ГРУППА ВЕЩЕСТВ, НЕ ТРЕБУЮЩИХ ОСОБЫХ МЕТОДОВ ИЗОЛИРОВАНИЯ. ВРЕДНЫЕ ПАРЫ И ГАЗЫ.
ОКСИД УГЛЕРОДА (II)
Из ядовитых газообразных веществ особое токсикологическое значение имеет оксид углерода (II), который можно обнаружить и определить количественно без изолирования непосредственно в биологическом объекте.
Оксид углерода (II), угарный газ (СО) - газ без цвета и запаха. С воздухом образует взрывоопасные смеси. Угарный газ находится везде, где существуют условия для неполного сгорания веществ, содержащих углерод. Токсическое действие. Окись углерода присоединяется к гемоглобину крови, образуя карбоксигемоглобин (НЬСО), в результате чего понижается содержание кислорода в крови и тканях (аноксемия и гипоксия). Низкие концентрации кислорода оказывает токсическое действие на клетки, нарушая дыхание тканей.
При остром отравлении угарным газом наступает головная боль, головокружение, тошнота, рвота, потеря сознания, коллапс, смерть. Симптомы отравления появляются при концентрации 0,2 мг на 1л воздуха и увеличиваются с повышение
Дата добавления: 2015-08-01; просмотров: 4032;
