АЛКАЛОИДЫ, ПРОИЗВОДНЫЕ ИЗОХИНОЛИНА 3 страница
Объекты для исследования:
1. Промывные воды желудка (если токсикант был принят внутрь, то промывные воды будут содержать его следы);
2. Желудок с содержимым, кишечник с содержимым (обнаруживаются остатки токсиканта, не успевшие всосаться в кровь);
3. Части печени, почек (аминазин метаболизируется в печени, частично выводится почками).
Аминазин относится к группе веществ, изолируемых подкисленным спиртом или подкисленной водой. Изолирование аминазина и его метаболитов рекомендуется производить спиртом, подкисленным до рН 2,0 - 3,0 10% раствором щавелевой кислоты, с последующей экстракцией основания эфиром при рН 13,0 и реэкстракцией вещества в 0,5 н раствор серной кислоты (изолирование по Е.М. Саломатину). Аминазин является соединением со слабыми основными свойствами, так как содержит в структуре третичный атом азота и при подкислении переходит в хорошо растворимую в воде и спирте ионизированную форму:
- при последующем повышении pH до 13,0 солевая форма переходит обратно в неионизированную форму, которая легко экстрагируется в эфир.
- при последующей реэкстракции раствором серной кислоты снова образуется протонированная форма аминазина.
Таким образом, за счет многократной реэкстракции происходит выделение анализируемого вещества и очистка от примесей.
Аналогично протекает извлечение из биологического материала основного метаболита аминазина – его сульфоксидного производного:
Также изолирование производных фенотиазина можно проводить путем экстракции из биологического материала подкисленной водой с последующей экстракцией органическим растворителем (диэтиловый эфир, хлороформ) из этого раствора, подщелоченного с помощью 25% раствора аммиака.
Предварительные испытания. В качестве предварительных испытаний на аминазин могут быть рекомендованы качественные реакции:
• С растворами йодида висмута в йодиде калия и фосфорно-молибденовой кислоты производные фенотиазина дают аморфные осадки
• С концентрированной серной кислотой возникает устойчивое пурпурно-красное окрашивание
• С формалином и серной кислотой производные фенотиазина дают пурпурно-красное окрашивание, усиливающееся при стоянии
• С концентрированной азотной кислотой возникает пурпурно-красное окрашивание (образование сульфоксида), которое быстро исчезает (образование сульфона).
• С 5% раствором золотохлористо-водородной кислоты аминазин (после 3-4 кратной обработки основания 0,1 М. раствором HCl) выделяется темно-красный аморфный осадок, переходящий через 20-50 мин. в характерный кристаллический осадок. Кристаллы в виде палочек и сростков из них, напоминают снопы и сфероиды. Кристаллы оптически активны (погасание косое, угол погасания 20-300, удлинение кристаллов положительное).
• С реактивами Марки и Фреде окраска производных фенотиазина — от красной до фиолетовой.
• С реактивом Манделина тизерцин дает красно-фиолетовую окраску; дипразин дает зеленую, переходящую в пурпурную окраску. Окраска у других производных фенотиазина — от красной до фиолетовой.
ТСХ-обнаружение
Для этого на хроматографическую пластинку стеклянным капилляром наносят каплю исследуемого раствора. Нанесенное пятно подсушивают на воздухе. Рядом наносят растворы известных препаратов, производных фенотиазина («свидетели») и вновь подсушивают пластинку. Затем пластинку вносят в камеру для хроматографии, насыщенную парами растворителя (смесь 25% раствора аммиака и этилового спирта в соотношении 1:1, либо 25% раствора аммиака, этилацетата и ацетона 4:90:45). После хроматографирования в указанных системах растворителей пластинку проявляют 50% раствором серной кислоты в этиловом спирте. Затем пластинку помещают на 3-5 мин в сушильный шкаф, нагретый до 1000С. Измеряют значение Rf проявившихся пятен, сравнивают их с Rf пятен «свидетелей» или со справочными значениями Rf. Аминазину соответствует значение Rf 0,35 во второй из приведенных выше систем растворителей.
5.5.25. ПРОИЗВОДНЫЕ 1.4-БЕНЗОДИАЗЕПИНА
Группа производных 1,4-бензодиазепина представлена разнообразными по структуре соединениями, обладающими широким спектром фармакологической активности и высокой эффективностью. С токсикологической точки зрения эта группа соединений представляет большой интерес для экспертов в связи с широкой распространенностью случаев передозировки. В настоящее время группа производных 1,4-бензодиазепина насчитывает порядка 100 широко распространенных представителей, структура которых весьма разнообразна. Свойства представителей группы напрямую связаны со структурой и весьма различны. В связи со сравнительно небольшой стоимостью, довольно широким спектром действия, высокой эффективностью и менее серьёзными побочными эффектами по сравнению с другими группами транквилизаторов, седативных веществ, нейролептиков производные 1,4-бензодиазепина доступны многим. Число отравлений этой группой веществ, особенно феназепамом, достигает высоких значений, что стимулирует поиск оптимальных методов анализа данной группы лекарственных средств.
- Структура
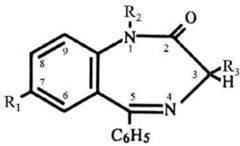
Таблица 7. Основные представители производных 1,4-бензодиазепина
| Соединение | R1 | R2 | R3 |
| Диазепам (сибазон) | -Cl | -СH3 | -H |
| Нитразепам (эуноктин) | -NO2 | -H | -H |
| Оксазепам (нозепам) | -Cl | -H | -OH |
| Хлордиазепоксид (хлозепид) | -Cl | -NH3CH3 | -H |
2. Физико-химические и химические свойства
Растворимость. Большинство 1,4-бенздиазепинов представляют собой бесцветные, хорошо кристаллизующиеся вещества. Практически нерастворимы в воде, растворимы в воде соли 1,4-бенздиазепинов, содержащих амино- (как у хлордиазепоксида) или карбоксильную группу в качестве заместителей. В органических растворителях растворимость зависит от структуры. Наиболее высокая растворимость наблюдается в диметилформамиде, диметилсульфоксиде.
Липофильность соединений определяется величиной коэффициента распределения (Кр) в системе вода - несмешивающийся в ней растворитель. Коэффициент распределения характеризует способность соединений проникать через биомембраны, а также определяет оптимальные условия экстракции соединений, из водной фазы в органический растворитель. Величины lg Кр производных 1,4-бенздиазепина в системе н-октан-фосфатный буфер (рН 7,4) следующие:
диазепам - 2,93
хлордиазепоксид -2,36
оксазепам - 2,24
нитразепам - 2,16
Ультрафиолетовые спектры
В электронных спектрах производных 1,4-бенздиазепина имеется 3 полосы поглощения с λmax в областях:
1. 200-215 нм
2. 220-240 нм
3. 290-330 нм
Две первые полосы соответствуют возбуждению ароматических хромофоров. Третью длинноволновую полосу относят к азометиновой связи, сопряженной с бензогруппой.
По характеру поглощения в УФ-области 1,4-бенздиазепины относятся к соединениям, абсорбция которых изменяется от величины значений рН:
- в кислой среде – за счет протонирования атома азота 1 (у хлордиазепоксида) и 4 (1,2-дигидропроизводных 1,4-бенздиазепина – нитразепам, оксазепам, диазепам);
- в щелочной среде в молекуле 1,2-дигидропроизводных 1,4-бенздиазепина наблюдается изменение хромофорной системы (увеличение сопряжения за счет лактим-лактамной таутомерии азометиновой связи в положения 1,2 - нитразепам, оксазепам).
Это свойство положено в основу идентификации соединений данной группы по электронным спектрам поглощения.
Кислотно-основные свойства
1,4-бензодиазепины являются слабыми основаниями. Основность соединений данного типа увеличивается при наличии основных заместителей. Так, хлордиазепоксид дает устойчивые соли с сильными кислотами, выступая в качестве однокислотного основания. При введении в ядро 1,4-бенздиазепинов нитро-, окси- и других групп основность соединений снижается.
1,2-дигидропроизводные 1,4-бенздиазепина (оксазепам, нитразепам) проявляют также слабокислые свойства за счет наличия в молекуле амидной группы.
В таблице представлены константы ионизации рКа1 и рКа2, характеризующие соответственно основность атома азота в четвертом положении и кислотность амидной группы (положение 1,2).
Таблица 8. Значение величин рКа производных 1,4-бенздиазепина:
| соединения | рКа1 | рКа2 |
| Диазепам (сибазон) Оксазепам (нозепам) Нитразепам (эуноктин) Хлордиазепоксид (хлозепид) | 4,76 3,6 1,6 2,93 | - - 11,1 10,94 |
Сопоставление величин рКа1 и рКа2 1,2-дигидропроизводных 1,4-бенздиазепина позволяет отметить передачу эффектов электронных смещений в молекуле. Электродонорные заместители, увеличивающие плотность электронов у атома азота в 4-ом положении, повышают основность, а электроноакцепторные заместители снижают ее. Введение заместителей в положения 3 и 1 снижает основность соединений, в основном, за счет стерического экранирования атома азота в 4-ом положении, затрудняющего его протонизацию. Кислотность амидной группы электроноакцепторные заместители увеличивают, а электронодонорные – уменьшают.
Гидролиз производных 1,4-бенздиазепина катализируется как кислотами, так и щелочами.
Кислотный гидролиз хлордиазепоксида (I), протекающий в мягких условиях, приводит к образованию 4-окси-1,2-дигидро-3Н-1,4-бенздиазепин-2-онов (II). В более жестких условиях эти соединения гидролизуются до 2-аминобензофенонов (III), альфа-аминокислот (IV) и аминов (V).
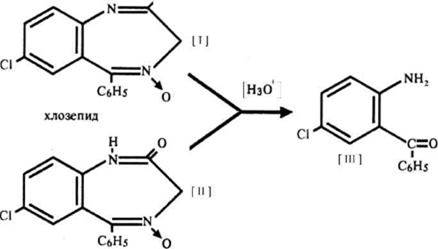
Процесс кислотного гидролиза 1,2-дигидропроизводных 1,4-бензодиазепина протекает по следующей схеме:
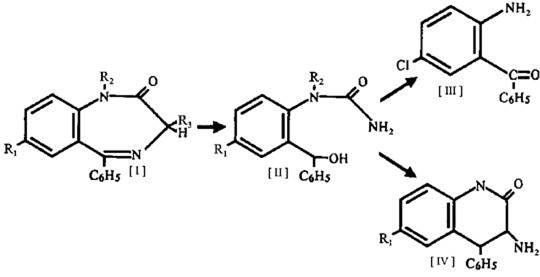
Продуктами гидролиза являются аминобензофеноны (III) и аминохинолоны (IV), образующиеся из промежуточного соединения (II). В процессе щелочного гидролиза 1,2-дигидропроизводных 1,4-бензодиазепина образуются соли аминокислот, которые при взаимодействии с кислотами образуют бензофенон и производные глицина.
3. Фармакокинетика производных 1,4-бензодиазепина.
Механизм всасывания - простая диффузия. Попадая в кровь, они на 80-95% связываются с белками плазмы, поэтому скорость абсорбции достаточно высокая (градиент концентрации направлен в кровь). Максимальная концентрация в крови при введении через рот достигается через 2-5 часов после введения терапевтических доз и через 4-8 часов – токсических доз препаратов. Далее концентрация их в крови сохраняется в течение 2-х часов на одном уровне, после чего начинает медленно снижаться.
Распределение производных 1,4-бензодиазепина по органам происходит в три стадии:
1-ая характеризуется падением концентрации в крови и накоплением в паренхиматозных органах;
на 2-ой стадии идет накопление соединений во всех органах. Предел накопления соединений в тканях определяется кажущимся объемом распределения (Vр);
3-я стадия, самая продолжительная по времени – характеризуется накоплением соединений в органах выделения (печени, почках), с одновременным уменьшением в остальных тканях органов.
Наибольшее содержание 1,4-бензодиазепинов в ЖКТ, тканях печени, почек.
Метаболизм
Попадая в организм, производные 1,4-бензодиазепина подвергаются различным метаболическим превращениям, которые катализируются монооксигеназами печени, локализованными в микросомах.
Окисление
1.1. N-деметилирование
1. В молекуле диазепама у атома азота в 1 положении
- В метиламинной группе хлордиазепоксида
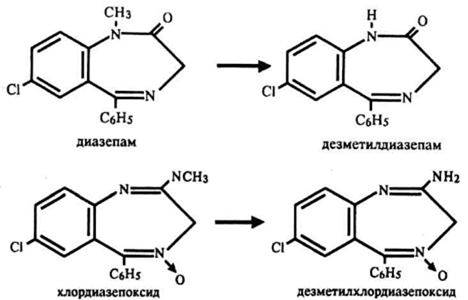
1.2. Гидроксилирование
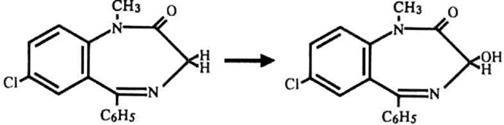
Восстановление нитрогруппы в молекуле нитразепама в седьмом положении углеродного атома (С7) до аминогруппы.
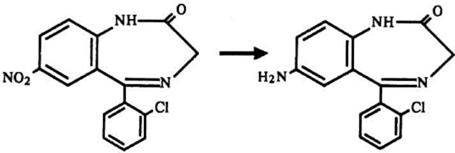
Синтез. Образование глюкуронидов 3-оксипроизводных 1,4-бенздиазепинов (оксазепам)
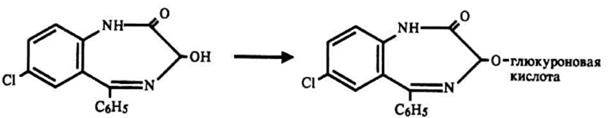
Метаболиты, образованные в результате процессов окисления и восстановления, фармакологически активны. Наибольшей активностью обладают метаболиты, полученные в процессе деалкилирования. Разрыв азепинового кольца при гидролизе 1,4-бенздиазепинов и образование глюкуронидов приводит к потере фармакологической активности. Наряду с основными соединениями продукты метаболизма обнаруживаются во всех тканях организма.
Выводятся производные 1,4-бенздиазепина, в основном, почками в виде основных соединений и метаболитов. Наличие в органах активных метаболитов производных 1,4-бенздиазепина снижает скорость элиминации. Время полувыведения (Т ½) при введении соединений через рот для:
хлордиазепоксида - 8-28 часов
диазепама - 20-42 часа
оксазепама - 10-14 часов
нитразепама - 7-10 часов
Интервал Т 1/2 зависит от принятой дозы LD > 500 мг.
3. Химико-токсикологическое исследование на производные 1,4-бензодиазепина.
Объектами исследования при интоксикации могут быть:
- лекарственные препараты и их остатки;
- биожидкости (кровь - содержит в основном неизмененное соединение, моча - содержит как основное соединение, так и метаболит);
- секционный материал (печень, желудочно-кишечный тракт, почки – содержат основное нативное соединение совместно с метаболитами).
В настоящее время можно выделить два направления в анализе производннх 1,4-бенздиазепина:
I направление - по продуктам гидролиза - 2-аминобензофенонам;
II направление - по содержанию в объектах исследования неизмененных соединений (нативных) совместно с метаболитами.
Основное преимущество исследования производных 1,4-бенздиазепина по продуктам гидролиза - 2-аминобензофенонам – особенно при их получении в процессе деструкции ткани, состоит в том, что данный способ позволяет суммарно определить нативные соединения и ряд метаболитов. При правильном проведении анализа ему придается отрицательное судебно-химическое значение.
При положительном результате необходимо продолжать исследование во втором направлении (по нативному соединению и метаболитам), что позволит более точно установить природу яда (особенно при наличии хлордиазепоксида, диазепама, оксазепама, которые имеют ряд обоих метаболитов и гидролизуются до 2-амино-5-хлор-бензофенона).
СХЕМА ИССЛЕДОВАНИЯ ПРОИЗВОДНЫХ 1,4-БЕНЗОДИАЗЕПИНА
I этап Гидролиз 1,4-бенз-диазепина
►
120оС, 20 мин.
6 М. HCl
II этап Гидролизат
III этап Экстракция 1,4-бенздиазепинов из гидролизата
►
Экстрагент хлороформ (1:1) 3 раза
IV этап 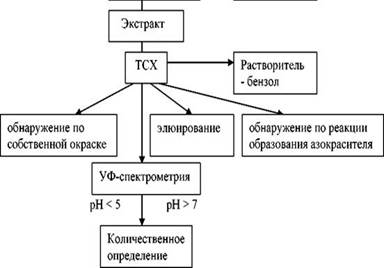
(УФ-спектрометрия λ max 265 нм λ max 235, 390 нм)
V этап
Анализ производных 1,4-бензодиазепина по 2-аминобензофенонам основан на свойстве соединений образовывать в процессе гидролиза различные по структуре 2-аминобензофеноны, их разделении в тонком слое сорбента и обнаружении на хроматограмме:
- по собственной желтой окраске;
- по азокрасителю, который образуется при сочетании соли диазония 2-аминобензофенона с β-нафтолом или N-α-нафтилэтилендиамином 2НСl (кроме 2-метиламинобензофенона, продукта гидролиза диазепама, т.к. ароматическая аминогруппа блокирована метильным (-СН3) радикалом).
В качестве дополнительного метода идентификации, подтверждающего результаты хроматографического исследования, используется спектрофотомерия в УФ-области, так как аминобензофеноны имеют характерные полосы абсорбции в области 200-400 нм. Количественная оценка содержания 1,4-бенздиазепинов проводится фотометрически по аминобензофенонам на основе реакции получения азокрасителя, с N-α-нафтилэтилен-диаминдихлоридом (реакция Браттона-Маршалла).
3.2. Этапы анализа по нативному соединению и основным метаболитам
1 этап: Извлечение, содержащее производные 1,4-бензодиазепина. Экстракция 1,4-бензодиазепинов в органический растворитель
2 этап: Исследование экстракта методом ТСХ
а) Обнаружение по окраске с реактивом Драгендорфа
Б) обнаружение по реакции образования азокрасителя после гидролиза соединений на хроматограмме.
3 этап: элюирование полосы силикагеля с пластинки, спектрофотомерия.
Исследование по нативному соединению и метаболитам дает возможностъ провести идентификацию производных 1,4-бенздиазепина внутри группы и подтвердить результаты анализа по 2-аминобензофенонам.
ТСХ аминобензофенонов производных 1,4-бенздиазепина Условия анализа:
Неподвижная фаза (сорбент): силикагель, закрепленный гипсом, нанесенный на стеклянную пластинку 9 х 12 см, или пластинки "Силуфол". Подвижная фаза: бензол
Время насыщения камеры парами растворителя – не менее 10 мин. Высота поднятия фронта растворителя – 10 см.
1.3.1. Нанесение веществ на пластинку:
| А 1 - Б 2 - В 3 - |
На стартовую линию в 1 и 3 точки нанесите по 2 капли стандартного раствора аминобензофенонов.
Первая точка – АХБ - 2-амино-5-хлорбензофенон, АНБ - 2-амино-5-нитробензофенон
(Зона А)
Вторая точка - объект исследования (экстракт из гидролизата) (Зона Б)
Третья точка - МХБ-2-метил-5-хлорбензофенон (Зона В)
Обнаружение на хроматограмме:
- по собственной желтой окраске;
- по характерной флуоресценции в УФ-области света (254-360 нм)
- по реакции образования азокрасителя с солью дназония аминобезофенонов с щелочным раствором β-нафтола (или N-α-нафтилэтилендиамин дихлоридом).
Методика обнаружения: Обработать слой сорбента зоны А, где располагаются АНБ и АХБ реагентами в последовательности:
- 2 М раствором НСl
- 0,1% раствором NаNO2
- щелочным раствором β-нафтола или раствором N-α-нафтилэтилендиамина. Зону В, содержащую МХБ (бензофенон диазепама) обработать 10% раствором НСlO4 и наблюдать флуоресценцию в УФ-свете при 254 и 360 нм.
- Изолирование из крови и мочи Вследствие особенностей распределения и метаболизма производных 1,4-бензодиазепина, их определение целесообразно проводить по продуктам их гидролиза -аминобензофенонам.
Это позволяет определить общее количество препаратов (как сумму нативного соединения и его метаболитов) в биологической жидкости.
Методика: к 10 мл анализируемой мочи или 2 мл крови добавляют соответственно 10 мл и 2 мл концентрированной HCl и нагревают в колбе или мерной пробирке с обратным холодильником на кипящей водяной бане в течение 1 часа. По окончании реакции гидролизат нейтрализуют насыщенным раствором NaOH, доводят рН до 8-10 и экстрагируют дважды хлороформом (10 мл х 2 для мочи и 5 мл х 2 для крови). Слой органического растворителя отделяют на делительной воронке, а затем в объединенных экстрактах упаривают органический растворитель под струей теплого воздуха до объема в несколько капель для ТСХ-анализа и досуха для количественного определения.
В настоящее время, как было сказано выше, можно выделить два основных направления в анализе объектов на 1,4-бензодиазепины:
а) по продуктам гидролиза - аминобензофенонам;
б) по нативным соединениям и метаболитам.
Первое направление предусматривает в основном кислотный гидролиз 1,4-бензодиазепинов и их метаболитов после предварительной экстракции, сорбции или в процессе деструкции ткани до соответствующих аминобензофенонов с последующим использованием для их идентификации сочетания хроматографических (ТСХ, ГЖХ, ВЭЖХ) и спектральных методов.
Второе, более сложное, включает изолирование нативных соединений и ряда гидрофобных метаболитов экстракцией подкисленной водой (органы и ткани) с последующим концентрированием экстракцией органическими растворителями или сорбцией. Для биологических жидкостей используется прямая экстракция органическими растворителями при рН = 6— 8 или сорбция на полисорбе-1. Далее для обнаружения и определения бензодиазепинов и их метаболитов используется комплекс аналитических методов.
Первое направление применимо при определении препаратов Хлозепида, Нозепама, Сибазона, Феназепама, Лоразепама, в меньшей степени Нитразепама (при анализе лекарственных форм и на отдельных этапах исследования биологических объектов). Малоизученным остается данное направление по отношению к Медазепаму.
Основное преимущество исследования 1,4-бензодиазепинов по производным аминобензофенона состоит в том, что данный способ позволяет суммарно определять нативное соединение и ряд его метаболитов. Отрицательному результату анализа гидролизованных бензодиазепинов придается "отрицательное судебно-химическое значение". При положительном результате необходимо продолжать исследование по нативным соединениям, что позволит более точно установить природу яда (особенно в случае Хлозепида, Нозепама и Сибазона).
Исследование по аминобензофенонам включает в себя три основных этапа: кислотный гидролиз, экстракцию аминобензофенонов и анализ экстрактов. Объекты (остатки лекарственных форм, моча, кровь, гомогенаты органов или экстракты из них) заливают 6 М НСl и нагревают при температуре 140 — 145°С в течение 60 минут (кровь, моча, части лекарственных форм, ткани печени, почек) или 80 — 90 минут (стенки желудка или кишечника). В случае направленного исследования на Сибазон, Нозепам, Нитразепам время гидролиза можно сократить до 30 минут, а температуру уменьшить до 120°С.
Аминобензофеноны из гидролизатов экстрагируют органическими растворителями при рН = 6 -8. В случае исследования внутренних органов экстракцию проводят после предварительного отделения гидролизата (фильтрованием, центрифугированием). Экстрагенты—хлороформ-изоамиловый спирт в соотношении 100:1 (гидролизаты тканей и органов, остатков лекарственных форм) или гептан (гидролизаты крови и мочи).
Хроматография в тонких слоях (силикагель) используется в основном при исследовании внутренних органов трупа, мочи и лекарственных форм. Метод предусматривает не только разделение аминобензофенонов, но и их обнаружение по собственной окраске, флюоресценции в УФ-свете (2-метиламино-5-хлорбензофенон), образованию азокрасителя с N-а-нафтилэтилендиамином, β-нафтолом и т.п. Предел обнаружения составляет 1 — 5 мкг аминобен-зофенона в пятне.
Аминобензофеноны из зон, не обработанных реагентами, можно элюировать (спиртом или ацетоном) для снятия электронных спектров и газохроматографического исследования. Основные полосы поглощения аминобензофенонов в этаноле можно наблюдать в области 230 - 240 и 390-410 нм.
При проведении исследования на 1,4-бензодиазепины по нативным соединениям объектами являются кровь, плазма, сыворотка, моча (не менее 10 мл), ткани печени, почек (не менее 200 г), желудок и тонкий кишечник с содержимым (не менее 200 г). Изъятые объекты по возможности быстро должны быть направлены на исследование в замороженном состоянии. Консервирование этанолом не рекомендуется. Анализ биологических объектов на 1,4-бензодиазепины желательно проводить незамедлительно.
Большинство 1,4-бензодиазепинов связывается с белками крови (в основном с альбумином), их терапевтические уровни могут быть определены современными методами ГЖХ и ВЭЖХ. Данные методы с успехом используются и при анализе мочи, иногда в сочетании с хроматографией в тонких слоях. Однако надо учитывать, что если кровь (плазма, сыворотка) является особенно ценным объектом для установления терапевтической, токсической или летальной концентрации 1,4-бензодиазепинов, то информация, полученная при хроматографическом исследовании мочи, позволяет более точно установить природу бензодиазепина. Соотношение концентраций "нативное соединение/метаболит" дает возможность установить длительность нахождения его в организме. Данные хроматографических (ТСХ) исследований производных 1,4-бензодиазепина приведены в таблице.
Таблица 9 . Значения Rf 1,4-бензодиазепинов в различных системах
| Системы растворителей | |||||
| Хлороформ-ацетон (80:20) | Этилацетат | Хлороформ-метанол (90:10) | Этилацетат- метанол-аммиак (85:10:5) | Метанол | |
| Хлозепид Диазепам Нитразепам Оксазепам | 0,62 0,75 0,72 0,56 | 0,00 0,23 0,00 0,00 | 0,50 0,73 0,53 0,40 | 0,10 0,58 0,35 0,22 | 0,51 0,77 0,60 0,00 |
Обнаружение производных 1,4-бензодиазепина производят реагентами, дающими различные окраски:
а) реактив Драгендорфа в разбавленной кислоте кислоте образует оранжевые и желто-оранжевые комплексные соли;
б) реактив FPN (железа (III) хлорид в смеси хлорной и азотной кислот) окисляет бензодиазепины с образованием окрашенных продуктов желтого цвета;
в) реактив Марки образует окрашенные продукты желтого цвета;
г) подкисленный йодплатинат образует темноокрашенные пятна.
Для ГЖХ обнаружения производных 1,4-бензодиазепина и их метаболитов используется общая система: стеклянная колонка 2 м х 4мм с 2,5% SE-30 на хромосорбе Q (80— 100 меш). Хлозепид и его метаболиты имеют следующие индексы удерживания: Хлозепид — 2453, демоксепам — 2529, дезметилдиазепам — 2496, Оксазепам — 2336, Диазепам — 2425, Нитразепам — 2885, 7-ацетамидо-нитразепам ~ 3263, 7-аминонитразепам — 2900, 7-амино-З-гидроксинитразепам — 2890.
Оптимальной комбинацией в анализе производных бензодиазепина является применение в качестве:
• предварительного метода анализа – метод ПФИА с использованием пороговой концентрации 100 нг/мл,
• подтверждающего метода анализа – метод газовой хроматографиии с масс- селективным детектором или газовой хроматографии с электронно-захватным детектором,
• метода количественного определения – высокоэффективная жидкостная хроматография с диодно-матричным детектором.
Сравнительный анализ методов пробоподготовки таких как жидкость-жидкостная и твёрдофазная экстракция показал, что при использовании ТФЭ:
• сокращается время проведения серийных анализов, что важно в рутинном химико-токсикологическом и судебно-химическом анализе,
• уменьшается расход органических растворителей, а, следовательно, вредное воздействие на персонал и окружающую среду,
• повышается качество извлечений, т.к. фирмами-производителями разработан широкий спектр патронов с высокоселективными сорбентами за счет специально подобранного состава для пробоподготовки биожидкостей, содержащих различные группы лекарственных и наркотических соединений.
Сочетание твердофазной экстракции с вышеперечисленными методами анализа позволяет проводить селективную экстракцию из биожидкостей с высоким выходом определяемых веществ и воспроизводимостью результатов.
Дата добавления: 2015-08-01; просмотров: 4347;
