СОВРЕМЕННЫЕ МЕТОДЫ АНАЛИЗА МЕТАЛЛОВ, ИСПОЛЬЗУЕМЕ В АНАЛИТИЧЕСКОЙ И ТОКСИКОЛОГИЧЕСКОЙ ХИМИИ (КРАТКИЙ ОБЗОР) 3 страница
Качественное обнаружение
- Реакция с хлоридом железа (III)
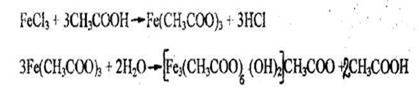
Появляется красная окраска. При нагревании окрашенного раствора происходит гидролиз, в результате которого выпадает бурый осадок.
Чувствительность реакции 1,25 мг.
- Реакция этерификации (образования этилацетата)
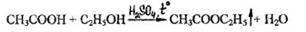
Появляется специфический запах этилацетата.
3. Реакция образования индиго
При нагревании уксусной кислоты с солями кальция образуется ацетон, который подвергается конденсации с о-нитробензальдегидом.
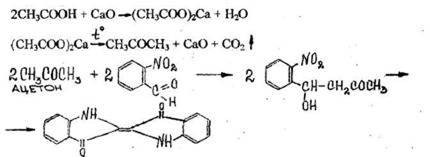
Отверстие пробки накрывают фильтровальной бумагой ,смоченной свежеприготовленным раствором о-нитробензальдегида в 5% растворе гидроксида натрия. Затем пробирку нагревают до прокаливания ее содержимого. На бумаге появляется синее пятно (окраска индиго).
Чувствительность реакции 10 мг.
- Реакция образования окиси какодила, обладающего неприятным запахом
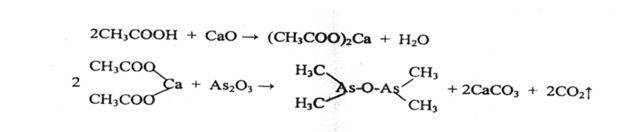
Чувствительность реакции 10 мг.
4.4.СПИРТЫ
Спирты, включенные в обязательный круг судебно-химического исследования при проведении общего анализа: метанол, этанол, пропанол, бутанол, амиловый. Токсикологическое значение спиртов связано с их широким применением в народном хозяйстве и в быту.
По физическим свойствам спирты - летучие жидкости и поэтому для их изолирования применяют метод перегонки с водяным паром. При этом учитывают взаимную растворимость изолируемого спирта и водяного пара. При исследовании токсических спиртов методом ГЖХ для изолирования в этом случае используют метод микродиффузии.
В последние годы наблюдается значительный рост числа интоксикаций, обусловленных употреблением спиртных напитков и суррогатов алкоголя. Это связано с резким повышением уровня алкоголизации населения, ростом количества некачественных спиртных напитков и употреблением с целью опьянения технических спиртсодержащих жидкостей. Смертельные отравления алкоголем и его суррогатами прочно занимают первое место и почти в 3 раза превышают по количеству летальных исходов следующие за ними интоксикации наркотиками.
4.4.1.ТОКСИЧЕСКОЕ ДЕЙСТВИЕ СПИРТОВ в первую очередь связано с их влиянием на ЦНС. Все спирты являются ядами ЦНС, так как обладают наркотическим действием и ослабляют процессы возбуждения.
Метиловый спирт избирательно поражает зрительный нерв и сетчатку глаз, что в 50% случаев приводит к слепоте. Обладает кумулятивными свойствами. Смертельная доза от 30 до 100 г, наступление слепоты возможно от принятия 7-8 г чистого спирта. При отравлении метанолом латентный период составляет 3-4 дня, но иногда смерть наступает очень быстро, в течении 30 минут, причем состояния опьянения при этом может и не быть.
Амиловый спирт обладает наркотическим действием поражая ЦНС, а также сильным местным раздражающим действием, вызывая некроз слизистых оболочек. Смертельная доза при приеме внутрь 10-15 г. При судебно-химическом исследовании органов трупа наводящим указанием является специфический запах изоамилового спирта, исходящий от биологического материала.
Этиловый спирт при приеме внутрь (острая интоксикация) вызывает вначале возбуждение, а затем угнетение и паралич ЦНС. Относится к веществам наркотического действия и вызывает пристрастие - алкоголизм. Наркотический эффект этанола зависит от скорости всасывания (резорбции), фазы интоксикации (стадии резорбции и элиминации), от концентрации в крови, толерантности. При длительном воздействии (хроническая интоксикация) на организм этанол может привести к тяжелым функциональным расстройствам нервной систем (алкогольные психозы - «белая горячка»: бред, галлюцинации с устрашающими видениями), вызвать поражение органов пищеварения, сердечно-сосудистой системы, жировое перерождение печени (цирроз) и т.д. Известно, что алкоголь влияет на потомство, приводя к рождению детей с умственными и физическими недостатками.
В последнее время обнаружено мощное токсическое воздействие этанола на биоритмы человека. При нарушении нормального хода этих биологических часов происходит рассогласование суточных ритмов - так называемая ресинхронизация, при этом у человека падает умственная и физическая работоспособность, нарушается сон, аппетит, изменяется обмен веществ. Исследования установили очень важный факт: вызываемые алкоголем нарушение психофизиологического состояния человека сохраняются и после полного выведения спирта из организме. Только на третьи сутки после приема алкоголя восстанавливаются разрушенные им суточные биоритмы.
Смертельная доза этанола при однократном приеме составляет 4-12 г на килограмм массы тела, то есть для взрослого человека она составляет около 300 мл чистого 96% спирта (без учета толерантности).
Алкогольная кома развивается при концентрации спирта в крови 3 г/л (3%>), абсолютно смертельная концентрация в крови - 5-6 г/л (5-6 %).
Токсикокинетика спиртов
Всасывание (резорбция). В организм спирты попадают через желудочно-кишечный тракт и легкие. Всасывание начинается быстро, уже во рту и пищеводе, но основная масса спирта всасывается в желудке или кишечнике. Механизм всасывания спирта - простая диффузия, молекулы его транспортируются в кровь в неизмененном виде. Скорость всасывания зависит от концентрации и количества принятого спирта, от степени и характера наполнения желудка и кишечника. При приеме натощак максимальная концентрация этанола в крови наблюдается через 40-80 мин ( в среднем около 1 часа), при полном желудке - через 1,5-2,5 часа.
Транспорт (распределение). Через кровь этанол распространяется по органам и тканям, обильно снабжаемым кровью, и концентрируется в тканях пропорционально содержанию в них воды. Наибольшие количество спирта содержатся в биологических жидкостях (кровь, моча, спинномозговая жидкость) и головном мозге. Несколько меньше его в тканях, мышцах, и минимальное количество - в жировой ткани. Небольшие количества этилового спирта могут присутствовать в биоматериале вследствие естественных процессов при гниении крови и других органов трупа.
Метаболизм (биотрансформация). После всасывания спирты подвергаются в организме процессам биотрансформации в основном через окисление до соответствующих альдегидов и кислот, конечными продуктами превращения которых являются СО2 и Н2О.
Так, метанол окисляется до формальдегида, а затем до муравьиной кислоты:
СН3ОН → Н2СО → НСООН → СО2 + Н2О
Этанол на 90% и более окисляется до ацетальдегида и уксусной кислоты:
С2Н5ОН → СН3СОН → СНзСООН → СО2+Н2О
Катализирует процесс фермент алькогольдегидрогеназа (АДГ), акцептором Н2 служит коэнзим никотинамид-аденин-динуклеотид (НАД).
Этот процесс протекает в основном в печени, меньше в легких, почках, мышечной ткани. У хронических алкоголиков процессы биохимического окисления спирта протекают, кроме того, в мышцах с помощью фермента каталазы, поэтому такие люди выносят большие дозы алкоголя.
Скорость метаболизма зависит, главным образом, от времени, очень незначительно - от концентрации спирта. У взрослого человека скорость метаболизма спирта около 10 мл/час, суточный метаболизм - 400-500 мл.
Метанол окисляется в организме значительно медленнее, его можно обнаружить в крови на 3-4 день после смерти.
Выделение (элиминация) спирта протекает по механизму простой диффузии и происходит через легкие, кожу, почки, кишечник, слюнные железы в виде метаболитов. Только 10% этанола выделяется в неизмененном виде, из них 7% - через легкие, 2-2,5% - почками.
Длительность нахождения (и обнаружения) алкоголя в организме человека обусловлена, в основном, количеством выпитого алкоголя и может быть определена с учетом скорости окисления, которая составляет 7-10 г алкоголя в час. Если в 100 мл водки содержится 40 мл алкоголя, тогда алкоголь может определяться в выдыхаемом воздухе, слюне и крови в течение 4-5 часов с момента употребления этой дозы напитка. В моче алкоголь может быть определен и позднее, так как в составе мочи он находится в мочевом пузыре долгое время до опорожнения пузыря. При приеме больших количеств алкоголя он содержится в организме до суток и более. При этом в конце этого срока к непосредственному действию алкоголя присоединяется влияние продуктов его распада, а также изменения внутренней среды организма, вызываемые интоксикацией алкоголем, такие как, например, гипогликемия и метаболический ацидоз. Именно этим объясняются симптомы, наблюдаемые после алкогольной интоксикации в период, когда алкоголя в организме уже нет: утомляемость, жажда, дрожание конечностей, головная боль, потливость, сердцебиение, колебание артериального давления, неустойчивое, а, нередко, и депрессивное настроение.
Объекты исследования и пробоподготовка
Наиболее важными объектами для судебно-химической экспертизы служат кровь и моча, реже ткани мозга, легких, печени, почек, редко - глубокие мышцы бедра. Желудок не может быть взят в качестве объекта исследования, так как возможно образование спирта естественным путем при брожении углеводов или при гнилостных процессах его содержимого. Содержание эндогенного алкоголя в крови находится в пределах 0,008-0,4%. При диагностике состояния алкогольного опьянения в наркологической практике объектами служат выдыхаемый воздух, слюна, кровь, моча.
Правила отбора проб для исследования
1. О правилах изъятия и направления на судебно-химическую экспертизу внутренних органов трупа, мы уже говорили.
2. При отборе жидких биологических сред у живых лиц также необходимо соблюдать определенные требования, а именно:
Моча отбирается в сухой стерильный флакон «под пробку». Флакон тотчас же закрывают пробкой. Отбор пробы мочи должен производиться в условиях, исключающих подмену или замену ее другими жидкостями.
Слюна отбирается в стерильный сухой флакон из-под пенициллина в количестве 5 мл и тут же закрывается пробкой.
Перед отбором пробы крови в сухой стерильный флакон из-под пенициллина закапывают 1-2 капли гепарина или 0,8 мл 3,8%-го раствора натрия цитрата и встряхиванием флакона смачивают его стенки.
Кровь в количестве 5 мл отбирается пункцией кубитальной вены при строгом соблюдении асептических условий самотеком во флакон, обработанный гепарином или цитратом. Флакон тотчас же закрывают стандартной резиновой пробкой, фиксируют пробку и содержимое флакона перемешивают. Кожа в месте пункции предварительно обрабатывается раствором сулемы 1:1000 или риванолом 1:500. Дезинфекция кожи спиртом, эфиром, настойкой йода не допускается.
У всех флаконов с отобранными пробами фиксируют пробки алюминиевыми колпачками с помощью приспособления для обжима колпачков, обеспечивающего герметизацию флакона, и ставят их в холодильник. В случае герметизации другим способом флаконы должны быть опечатаны. На каждый флакон наклеивается этикетка с указанием номера пробы (по регистрационной книге), даты, времени забора пробы, фамилии освидетельствуемого, фамилии медицинского работника, подготовившего пробу.
Биосреды должны исследоваться позднее суток с момента их отбора. Допускается их хранение в холодильнике при температуре -4° С в течение 5 суток.
4.4.2. ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ. МЕТОДЫ АНАЛИЗА В СУДЕБНО-ХИМИЧЕСКОЙ ЭКСПЕРТИЗЕ ОТРАВЛЕНИЙ И ЭКСПЕРТИЗЕ АЛКОГОЛЬНОГО ОПЬЯНЕНИЯ
ЭКСПЕРТИЗЕ ОТРАВЛЕНИЙ И ЭКСПЕРТИЗЕ АЛКОГОЛЬНОГО ОПЬЯНЕНИЯ
При судебно-химических исследованиях для доказательства спиртов используют их общие свойства (химизм всех реакций приведен в ниже в данном электронном методическом пособии):
1. Реакция этерификации основана на способности спиртов вступать в реакцию образования сложных эфиров при взаимодействии с органическими кислотами в присутствии концентрированной серной кислоты.
Из реакций образования сложных эфиров аналитическое значение для СНзОН имеет реакция образования метилсалицилата, С2Н5ОН - этилацетата и этилбензоата, C5H11OH - амилацетата.
Продукты реакции определяют только по запаху, что снижает аналитическое значение реакции, так как большую роль играет субъективный фактор исследователя.
Реакция образования сложных эфиров высокочувствительна, но не специфична, поэтому ей придается отрицательное судебно-химическое значение. При положительном результате реакции необходимо подтвердить наличие того или иного спирта дополнительными испытаниями.
2. Реакция окисления основана на способности спиртов окисляться до соответствующих альдегидов, которые обнаруживаются по запаху или по реакции окрашивания.
Метанол окисляется до формальдегида, который обнаруживают по наиболее чувствительным для него реакциям окрашивания с кодеином в концентрированной серной кислоте и с фуксинсернистой кислотой (сине-фиолетовое окрашивание).
Поскольку метанол определяют по продукту его окисления -формальдегиду, исследуемый отгон необходимо предварительно проверить на отсутствие формальдегида, чтобы избежать ошибки переоткрытия метанола.
В отсутствие формальдегида реакция имеет положительное судебно-химическое значение для метанола и позволяет обнаружить метанол в присутствии других спиртов.
Этиловый спирт окисляется до ацетальдегида , а изоамиловый спирт - до изовалерианового альдегида, которые обладают характерным запахом и определяются по его наличию.
В судебно-химических исследованиях иногда приходится решать задачу обнаружения какого-либо спирта при возможном присутствии других. Для этого должны быть использованы специфичные реакции, позволяющие отличить спирты друг от друга при их совместном присутствии.
Реакциями отличия служат:
1) для СНзОН - как уже говорилось, окисление до Н2СО с последующим его обнаружением цветными реакциями.
2) для С2Н5ОН - реакция образования кристаллического осадка йодоформа.
3) для C5H11OH реакция отличия высших спиртов (С3-C5) от низших (СН3ОН и С2Н5ОН) - взаимодействие с ароматическими альдегидами - салициловым, п-диметиламинобензальдегидом и другими (реакция Комаровского).
Таким образом, при судебно-химических исследованиях доказательство этанола в дистилляте строится на общих реакциях и реакции образования йодоформа. Этой реакции придается отрицательное судебно-химическое значение, то есть по ней можно делать вывод только о необнаружении этанола. Исследование на этанол обязательно начинается с йодоформной пробы, а при положительном ее результате требуется выполнить все остальные реакции.
Заключение о нахождении этанола делается по комплексу положительных результатов всех реакций.
4.4.2.1. МЕТИЛОВЫЙ СПИРТ (метанол, древесный спирт, карбинол) СН3ОН
Представляет собой бесцветную жидкость с характерным запахом, смешивается во всех соотношениях с водой, эфиром, этиловым и другими
спиртами; хороший растворитель жиров, липидов, масел и других органических веществ. По запаху и вкусу напоминает этанол. Горит бледным пламенем,
т. кип. 64-65 °С.
Применяется метанол в лакокрасочной промышленности, для получения формальдегида, синтеза различных органических соединений, денатурированного этилового, является добавкой к топливу и антифризам. Метанол быстро всасывается в желудке и тонком кишечнике, метаболизируется в основном в печени с помощью фермента алкогольдегидрогеназы (АДГ).
Окисление метанола протекает значительно медленнее, чем этанола. Метанол и его метаболиты выводятся почками, 15 % в неизменном виде через легкие. Формальдегид и муравьиная кислота - продукты метаболизма -обусловливают высокую токсичность метанола. Токсическое действие связано с действием на ЦНС, на зрительный нерв и отдел мозга, отвечающий за зрение. Летальная доза =100 мл. Токсическая ~ 20 мл. Смерть наступает от острой сердечной недостаточности и от остановки дыхания.
Качественное обнаружение:
- Реакция этерификации (образование метилсалицилата)
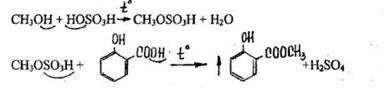
Ощущается запах метилового эфира салициловой кислоты.
Чувствительность реакции 0,3 мг.
- Реакция окисления до формальдегида и обнаружение последнего реакциями окрашивания.
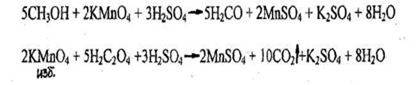
Через 15-20 минут для обесцвечивания избытка калия перманганата добавляют кристаллическую щавелевую кислоту, жидкость делят на 2 части и проделывают реакции:
А) с кодеином в серной среде
Б) с фуксинсернистой кислотой
Чувствительность обеих реакций 0,1 мг.
- Предварительная проба на метанол в биологической жидкости (моча)
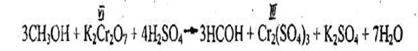
К I мл мочи прибавляют 1 мл 10% раствора калия дихромата в 50% растворе серной кислоты. Появляется зеленая окраска в течение 10-45 сек. (предел обнаружения 75 мг % спирта).
Реакция не специфична для метанола и имеет отрицательное судебно-химическое значение.
4.4.2.2. ЭТИЛОВЫЙ СПИРТ (этанол, метилкарбинол, винный спирт) С2Н5ОН
Этиловый спирт - бесцветная легкоподвижная жидкость с характерным запахом и жгучим вкусом; т. кип. 78,39 °С. Смешивается с водой, спиртами, диэтиловым эфиром, глицерином, хлороформом, ацетальдегидом, бензином и др.; образует азеотропную смесь водой (95,6 % по массе этанола, т. кип. 78,15 °С).
Применяют этиловый спирт в лакокрасочной и фармацевтической промышленности, в производстве кинофотоматериалов, товаров бытовой химии и др. Является сырьём в производстве диэтилового эфира, хлороформа, ацетальдегида, уксусной кислоты, этилацетата и др. В медицине этиловый спирт применяют для дезинфекции, как поверхностное сосудорасширяющее средство, коагулянт белка, в том числе при лечении ожогов. Значительная часть этилового спирта идет на изготовление спиртных напитков.
Этиловый спирт чрезвычайно гигроскопичен, при концентрации выше 70 % (по объёму) прижигает кожу и слизистые оболочки; при приёме внутрь угнетает центры торможения мозга, вызывает опьянение, при многократном употреблении - алкоголизм.
Качественное обнаружение
1. Реакция этерификации (образование этилацетата)
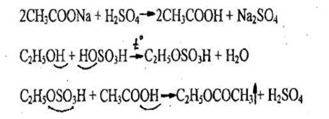
Ощущается запах этилацетата, который появляется более отчетливо, если содержимое пробирки вылить в 20-25 кратный объем воды.
Чувствительность реакции 15-20 мг.
2. Реакция окисления
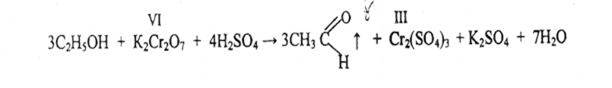
Чувствительность реакции 3 мг.
3 .Реакция образования йодоформа

При охлаждении раствора образуются кристаллы йодоформа в виде шестиугольников и звездочек.
Реакция не специфична, ее дает ацетон.
Чувствительность реакции 0,04 мг.
Предварительная проба на этанол в биологической жидкости (моча) проводится аналогично описанной выше пробе для метанола.
Реакция имеет отрицательное судебно-химическое значение.
4.4.2.3. ИЗОАМИЛОВЫЙ СПИРТ (3-метил-1-бутанол) (СН3)2СН-СН2-СН2-ОН
В промышленности получают смесь первичных спиртов (1-пентанола и 2-метил-1-бутанола), выпускаемую под названием амиловые спирты, а также изоамиловый спирт (3-метил-1-бутанол). Смесь 2-метил- и З-метил-1-бутанолов выделяют из сивушного масла, в состав которого также входят пропиловый и бутиловый спирты. Кроме того, в сивушном масле содержатся (около 1 %) высшие спирты (с 6-9 атомами углерода), некоторые жирные кислоты и азотистые вещества. Сивушное масло - побочный продукт спиртового брожения, очень ядовито. Изоамиловый спирт представляет собой маслянистую жидкость с очень резким характерным запахом. Часто при хранении приобретают желтоватую окраску. Обладают сильным раздражающим действием на слизистые. Поражают ЦНС. Летальная доза 20 мл. Токсический эффект наступает от 0,5 мл. Возникают ощущение глухоты, рвотные выделения, бред. При остром отравлении наблюдается коматозное состояние. Недопустимо содержание в спиртных напитках даже 0,3 % амиловых спиртов (сивушного масла).
3-Метил-1-бутанол растворим в воде, т. кип. 131,4 °С; образует азеотропную смесь с водой (т. кип. 95,15 С, 49,6 % воды).
Исследование на присутствие изоамилового спирта проводят при наличии специфического запаха сивушных масел и маслянистых капель на поверхности дистиллята. Все реакции на изоамиловый спирт дают положительный эффект только при отсутствии воды, поэтому перед выполнением реакций изоамиловый спирт экстрагируют из дистиллята диэтиловым эфиром (3 мл), эфирную вытяжку делят на 3 части и эфир испаряют при комнатной температуре. С полученными остатками проделывают реакции 1-3.
Качественное обнаружение
Исследование на наличие изоамилового спирта проводится при наличии специфического запаха сивушных масел и маслянистых капель на поверхности дистиллята. Все реакции на изоамиловый спирт дают положительный эффект только при отсутствии воды, поэтому перед выполнением реакций изоамиловый спирт экстрагируют из дистиллята эфиром (3 мл), эфирную вытяжку делят на 3 части и эфир испаряют при комнатной температуре. С полученными остатками проделывают реакции 1-3.
- Реакция этерификации (образование изоамилацетата)
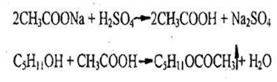
Чувствительность реакции 0,15 мг.
При слабом нагревании ощущается запах грушевой эссенции, который становиться более выраженным при разбавлении реакционной смеси водой.
Реакция имеет отрицательное судебно-химическое значение.
- Реакция окисления (образование изовалерианового альдегида).
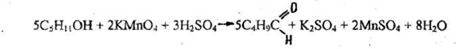
Появляется запах изовалерианового альдегида, при стоянии переходящий в неприятный запах изовалериановой кислоты (запах гнилого сыра).
Чувствительность реакции 0,11 мг.
3. Реакция Комаровского с ароматическими альдегидами (на высшие спирты, содержащие более 3 атомов углерода).
А) Реакция с салициловым альдегидом:
Возможный механизм реакции включает в себя окисление изоамилового спирта концентрированной серной кислотой до изовалерианового альдегида, который вступает в реакцию конденсации с ароматическим альдегидом.
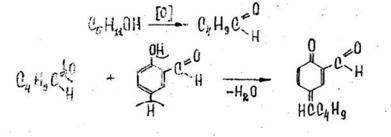
К остатку в фарфоровой чашке после испарения эфира прибавляют 1 мл 1% раствора салицилового альдегида в этаноле и 3 мл концентрированной серной кислоты. После охлаждения содержимого чашки ее помещают на 3 мин. на кипящую водяную баню. Появляется розово-красная окраска.
Чувствительность реакции 1,5 мг.
Б) Реакция с п-диметиламинобензальдегидом.
В фарфоровой чашке на остаток после испарения эфира наносят 5-10 капель концентрированной серной кислоты и несколько кристаллов п-диметиламинобензальдегида. Появляется темно-красное окрашивание, переходящее при разбавлении водой в фиолетовое.
4,4.2.4. ПРОПИЛОВЫЕ СПИРТЫ (С3Н7ОН)
Среди них выделяют нормальный пропиловый (пропанол) и изопропиловый (пропанол-2, вторичный пропиловый, петрогол, перспирит) спирты. Это бесцветные жидкости с характерным спиртовым запахом, хорошо смешиваются с водой, этанолом, бензолом. Т. кип. пропанола 97,4 °С. Получают перегонкой сивушных масел и синтетическим путем. Т. кип. пропанола-2 - 82,4 °С. Используют пропиловые спирты в качестве растворителей синтетических смол, некоторых эфирных масел и т.д. Изопропиловый спирт применяют в качестве антифриза. Оказывает вредное влияние на ЦНС, токсичнее этанола приблизительно в 2 раза. Отравление чистыми пропиловыми спиртами вследствие приёма их внутрь наблюдаются сравнительно редко, чаще встречаются интоксикации их смесью с этиловым спиртом.
4.4.2.5. БУТИЛОВЫЕ СПИРТЫ (бутанолы) С4Н9ОН
Бесцветные жидкости с характерным спиртовым запахом. Получаются при брожении некоторых злаков, из отходов сахарного производства, а также синтетическим путем. К ним относятся: н-бутиловый (бутанол-1) с т. кип. 117,4 °С; плохо растворим в воде; втор-бутиловый (бутанол-2), с т. кип. 99,5-100 °С; в воде растворяется хуже, чем бутанол-1; изобутиловый с т. кип. 108,1 °С, плохо растворим в воде; трет-бутиловый спирт (триметилкарбинол) с т. кип. 82,5 °С, в воде растворяется неограниченно.
Применяются бутиловые спирты в качестве растворителей в парфюмерной и фармацевтической промышленности, в производстве синтетического каучука, для изготовления тормозной жидкости БСК (содержащей до 50 % бутанола) и т.д.
4.4.2.6. ЭТИЛЕНГЛИКОЛЬ (1,2-этандиол) НОСН2СН2ОН
Этиленгликоль - это двухатомный спирт жирного ряда, бесцветная вязкая гигроскопичная жидкость без запаха, сладковатого вкуса, т. кип. 197, °С. Хорошо растворим в воде, спиртах, кетонах и др., умеренно - в бензоле, толуоле, диэтиловом эфире, четыреххлористом углероде. В этиленгликоле плохо растворимы растительные и животные масла. Применяется в органическом синтезе, кожевенной, текстильной, табачной, фармацевтической, парфюмерной промышленности. Водные растворы этиленгликоля обладают низкими температурами замерзания. Это их свойство используется при создании антифризов, тормозных жидкостей и антиобледенителей.
Этиленгликоль токсичен при попадании внутрь - действует повреждающе на ЦНС, обменные процессы, эндотелий сосудов и почек (некронефроз). Выводится из организма очень медленно (от 14 до 50 дней). Легко окисляется в организме в щавелевую кислоту. Смертельная доза - 100 мл и больше.
Отравление может протекать в двух формах - мозговой или гепаторенальной в последнем случае - с выраженной почечной и печеночной недостаточностью).
Качественное обнаружение. Определение этиленгликоля в остатках принятой жидкости основано на его окислении до щавелевой кислоты с последующим образованием оксалатов: до формальдегида, который обнаруживают реакцией с фуксинсернистой кислотой. Для определения этиленгликоля в остатках принятой жидкости также используют реакцию этиленгликоля с сульфатом меди в присутствии щелочи, в результате которой образуется соединение, имеющее синюю окраску.
1. Реакция окисления перйодатом калия и обнаружение образовавшегося формальдегида реакцией с фуксинсернистой кислотой
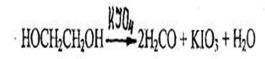
Появляется красно-фиолетовое или розовое окрашивание.
2. Реакция окисления до щавелевой кислоты при многократном выпаривании этиленгликоля с азотной кислотой
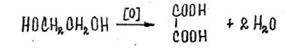
Образующуюся щавелевую кислоту доказывают:
А) по характерным кристаллам оксалата кальция.
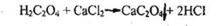
Б) по обесцвечиванию раствора перманганата кадия
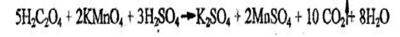
3. Реакция с сульфатом меди (голубое окрашивание раствора)
Реакция применяется для обнаружения этиленгликоля в технических жидкостях, для дистиллятов неприемлема.
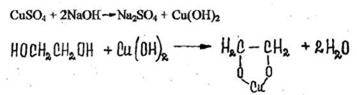
Появляется голубая окраска.
4.4.3. ЭКСПЕРТИЗА АЛКОГОЛЬНОГО ОПЬЯНЕНИЯ. КЛИНИЧЕСКАЯ ДИАГНОСТИКА
Известно, насколько широко распространен алкоголизм (то есть пристрастие к алкоголю) и как велика его социальная опасность (об этом уже говорилось). Законодательством установлена дисциплинарная и административная ответственность за пребывание в нетрезвом виде в общественных местах, на рабочем месте, а также за управление транспортными средствами. При совершении правонарушений и преступлений степень опьянения служит отягчающим фактором и влияет на квалификацию преступного деяния, а, следовательно, и на меру ответственности. Для установления факта употребления алкоголя или степени алкогольного опьянения проводится медицинское освидетельствование, а при возбуждении уголовного дела - экспертиза алкогольного опьянения.
Дата добавления: 2015-08-01; просмотров: 3103;
