СОВРЕМЕННЫЕ МЕТОДЫ АНАЛИЗА МЕТАЛЛОВ, ИСПОЛЬЗУЕМЕ В АНАЛИТИЧЕСКОЙ И ТОКСИКОЛОГИЧЕСКОЙ ХИМИИ (КРАТКИЙ ОБЗОР) 2 страница
Метод основан на ускоренной диффузии «летучих» веществ биологической пробы при повышенной температуре в присутствии сильных электролитов и проводится в герметически закрытом флаконе. Парогазовая фаза отбирается микрошприцем и используется для анализа.
Микродиффузия. Не потерял своего значения и метод микродиффузии, позволяющий обнаружить малые количества в объекте. Прибор для микродиффузии представляет собой небольшой круглый толстостенный сосуд из стекла, внутри которого расположен второй сосуд меньшего диаметра. Таким образом, имеется внутренняя круговая стенка и наружная кольцевая камеры. К верхнему краю герметично пришлифовывается крышка.
Исследуемый объект вносится в наружную камеру, а поглощающая жидкость - во внутреннюю. К объекту в наружную камеру на расстоянии 2-3 см от него помещают раствор вещества-электролита, который способствует переходу летучего соединения в пространство прибора. Прибор закрывают крышкой, слегка наклоняют для смешивания объекта и электролита, после чего оставляют на время, необходимое для диффузии. При этом летучие вещества из объекта сначала переходят в пространство прибора, а затем в растворитель во внутренней камере (или в раствор реактивов, реагирующих с этими веществами). В этой жидкости их и определяют.
На скорость перехода летучих веществ в пространство прибора влияют некоторые электролиты. Так, прибавление раствора калия карбоната к крови или тканям, содержащим этанол, ускоряет его диффузию.
4.3. ТОКСИКОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ НЕКОТОРЫХ ЛЕТУЧИХ ЯДОВ
4.3.1.СИНИЛЬНАЯ КИСЛОТА (цианистый водород, нитрил муравьиной кислоты)
Синильная кислота HCN представляет собой бесцветную, подвижную жидкость с запахом горького миндаля. Т. кип. 25,65 °С. Смешивается с водой и многими органическими растворителями (спирты, эфиры, ароматические углеводороды, четыреххлористый углерод и др.). Синильная кислота - слабая кислота, образует с металлами соли - цианиды.
В свободном и связанном виде синильная кислота встречается в растениях, чаще всего в виде гликозида амигдалина, содержится в коксовом газе, табачном дыме, образуется при термическом разложении найлона, полиуретанов и др.
Синильную кислоту применяют в производстве цианидов, хлорциана,
акрилонитрила, акрилатов, аминокислот, гидроксинитрилов, как фумигант.
Сильно токсична, задерживает окислительные и ферментативные процессы,
связывает гемоглобин в циангемоглобин, парализует дыхательный центр и вызывает удушье; проникает через неповрежденную кожу.
Цианиды калия и натрия - реагенты для извлечения серебра и золота из руд, реактивы в комплексонометрическом анализе для определения серебра, никеля и ртути, компоненты электролитов для очистки платины от серебра и для гальванического золочения и серебрения. Высокотоксичны, вызывают удушье вследствие паралича тканевого дыхания. Порошки и растворы KCN раздражают кожу.
Качественное обнаружение синильной кислоты
1. Реакция образования берлинской лазури
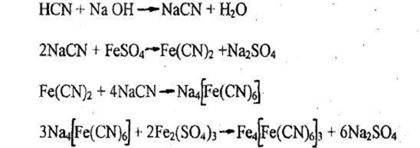
Появление синего осадка или синей окраски указывают на наличие синильной кислоты. При малых количествах синильной кислоты в растворах окраска появляется только через 24-48 час.
При изучении данной реакции следует проделать ее несколько раз со все уменьшающейся концентрацией исследуемого вещества в растворе.
Чувствительность реакции - 20 мкг синильной кислоты в 1 мл раствора. Реакция специфична и имеет положительное судебно-химическое значение.
2. Реакция образования роданида железа
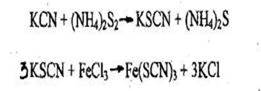
Появление кроваво-красной окраски указывает на наличие цианидов в растворе. При взбалтывании окрашенного раствора с диэтиловым эфиром окраска переходит в эфирный слой.
Чувствительность реакции - 10 мкг синильной кислоты в 1 мл.
Обнаружение цианидов методом микродиффузии
Метод микродиффузии обнаружения синильной кислоты и её солей основан на реакции с пиридином и барбитуровой кислотой. Суть реакции заключается в расщеплении пиридинового цикла при действии хлорамина Т в щелочной среде - с образованием производного глутаконового альдегида. Производное глутаконового альдегида малоустойчивое соединение, существующий в двух таутомерных формах, который далее конденсируется с барбитуровой кислотой с образованием окрашенного соединения.
В наружную камеру прибора для микродиффузии вносят 2-4 мл крови
или мочи (или 1 г гомогената ткани), прибавляют 3-4 капли 10 % раствора
кислоты серной. Во внутреннюю камеру прибора наливают 3,3 мл 0,1 моль/л
раствора натрия гидроксида. Прибор плотно закрывают крышкой и оставляют на 3-4 ч при комнатной температуре. Затем из внутренней камеры берут 1 мл жидкости, прибавляют 1 мл 0,1 моль/л раствора натрия гидроксида , 2 мл 1 моль/л раствора натрия гидрофосфата и 1 мл 0,25 моль/л раствора хлорамина Т. Жидкость взбалтывают и через 2-3 мин прибавляют 3 мл реактива, содержащего барбитуровую кислоту и пиридин. Смесь взбалтывают и оставляют на 10 мин. Появление красной окраски указывает на присутствие цианидов в исследуемой жидкости.
Количественное определение
Для количественного определения изолирование синильной кислоты
проводят из отдельной навески биологического материала. Перегонку ведут до тех пор, пока последняя порция дистиллята не перестанет давать реакции образования берлинской лазури. При исследовании свежего биологического материала можно использовать титриметрический метод анализа. Весовой метод применяют к свежему и загнившему биологическому материалу.
1. Титриметрический метод. Метод основан на взаимодействии синильной кислоты с 0,1 моль/л (или 0,01 моль/л при малых количествах синильной кислоты) раствором серебра нитрата. Непрореагировавший серебра нитрат оттитровывают 0,1 моль/л (или 0,01 моль/л) раствором аммония или калия тиоцианата, индикатор - железо-аммониевые квасцы.
2. Весовой метод. Дистиллят собирают в 2-3 приёмника, соединенных между собой и содержащих 0,2 % раствор серебра нитрата. По окончании отгонки содержимое приёмников обмывают водой очищенной и промывные воды присоединяют к основной жидкости. Раствор подкисляют кислотой азотной до кислой реакции по лакмусу и осадок количественно переносят на фильтр. Полученный осадок промывают раствором аммиака для растворения серебра цианида от нерастворимого в нём серебра сульфида. Фильтрат подкисляют кислотой азотной разбавленной до резко кислой реакции (рН1-2) на лакмус, выделившийся осадок серебра цианида отфильтровывают, промывают водой очищенной и высушивают вместе с фильтром. Затем фильтр сжигают и осадок прокаливают во взвешенном фарфоровом тигле до постоянного веса.
Осадок металлического серебра взвешивают и пересчитывают на кислоту синильную по формуле:
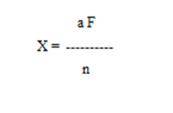
где X - количество исследуемого вещества в мг;
а - вес весовой формы в мг;
F - коэффициент пересчёта, равный для синильной кислоты (по серебру);
n - навеска исследуемого вещества в г.
4.3.2. АЛКИЛГАЛОГЕНИДЫ
Алкилгалогениды находят широкое применение в лакокрасочной, кожевенной, электротехнической, фармацевтической промышленности; при приготовлении полимерных материалов как пластификаторы, мономеры и сополимеры. Используются в качестве растворителей, в том числе для обезжиривания и экстрагирования жиров и эфирных масел, хладагентов, пестицидов, в органическом синтезе, при производстве каучука, резинотехнических изделий.
Почти все хлорпроизводные алканов опасные яды. Максимальная смертность отмечается при отравлениях хлороформом, четырёххлористым углеродом, 1,2-дихлорэтаном. В картине отравления помимо фазы наркоза, которая проявляется преимущественно при ингаляционных отравлениях, выделяют и токсическую. Токсическая фаза, протекающая с поражением печени, почек и ЦНС, наиболее выражена при приёме хлорпроизводных алканов внутрь, но отмечается и при других путях поступления. Токсичность хлорпроизводных алканов усиливается при одновременном или предварительном действии этанола, как при ингаляции, так и при внутрижелудочном введении. Потенцирующее действие отмечается при комбинации хлорпроизводных алканов и с другими алифатическими спиртами.
Усиление загрязнения окружающей среды хлорпроизводными углеводородов - вероятная причина роста раковых заболеваний.
Поступают в организм при ингаляции, перорально, через кожные покровы.
Определение летучих хлорпроизводных алканов в выдыхаемом воздухе основано на последовательном применении ГХ и масс-спектрометрии. Используют также ГЖХ и хромато-масс-спектрометрический метод. В воде -ГХ и спектрофотометрические. В биологическом материале определяют ГХ и масс-спектрометрическими методами. Применяют также хроматографию в тонком слое. Сохраняют значение методы, основанные на реакции Фудживара - окрашивание раствора пиридина при взаимодействии с хропроизводными углеводородов в щелочной среде.
4.3.2.1.ХЛОРОФОРМ(трихлорметан) СНСl3
Хлороформ представляет собой бесцветную прозрачную жидкость с резким характерным запахом, сладковатым, жгучим вкусом; т. кип. 61,1°С; образует азеотропную смесь с водой (т. кип. 56,2 °С, 97,4 % хлороформа). Используют хлороформ главным образом для производства хладона 22, как растворитель, хладагент, в синтезе лекарственных препаратов. Ранее применялся в медицине как средство для наркоза. Хлороформ - негорюч, на свету разлагается, особенно при контакте с открытым пламенем, образуя фосген. Вызывает наркоз. Обладает гепатотропным, нефротоксическим и кардиотоксическим действием; вызывает канцерогенный и мутагенный эффекты; раздражает слизистые оболочки.
Качественное обнаружение
- Реакция отщепления атомов хлора
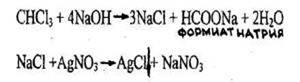
Появляется белый осадок, растворимый в растворе аммиака. Параллельно проводят пробу в тех же условиях с 1 мл исследуемого раствора и натрия гидроксидом, но без нагревания (для исключения ионов хлора в исследуемом растворе).
Реакция не специфична, является общей для всех хлорпроизводных. Чувствительность реакции 0,2 мг.
- Реакция с резорцином в щелочной среде
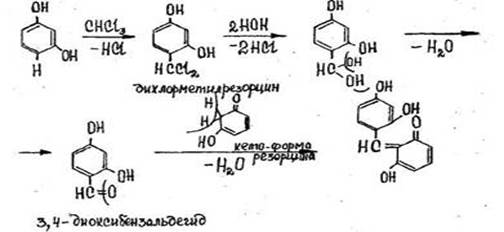
После нагревания пробирки на кипящей водяной бане в течение 5-10 мин. появляется розовая или малиновая окраска. Параллельно выполняется контрольный опыт («слепой» опыт), цель которого - исключить ошибки за счет продуктов окисления резорцина, окрашенных в зеленый цвет и маскирующих розовое окрашивание.
Реакция не специфична, ее дают все хлорпроизводные, кроме дихлорэтана, а также формальдегид.
- Реакция образования изонитрила
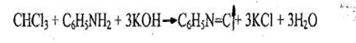
Появляется резкий раздражающий запах изонитрила. Реакция не специфична, ее дают все хлорпроизводные, за исключением дихлорэтана.
Чувствительность реакции 0,01 мг.
- Реакция с реактивом Фелинга.
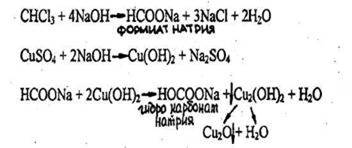
Выпадает желтый осадок гидрооксида меди (Cu(OH)2), переходящий в красный осадок закиси меди (Cu2O).
Реакция не специфична, ее дает хлороформ, хлоралгидрат и формальдегид. Не дают четыреххлористый углерод и дихлорэтан. Чувствительность реакции 3 мг.
4.3.2.2. ХЛОРАЛГИДРАТ (2,2,2-трихлорэтандиол-1,1) СС13СН(ОН)2
Бесцветные, прозрачные кристаллы или мелкокристаллический порошок с характерным острым запахом, слегка горьковатого вкуса. Т.пл. 51,4 °С, т. кип. 97,5 °С. Растворим в этаноле, диэтиловом эфире, слабо растворим в бензоле, сероуглероде.
Применяют как успокаивающее внутрь и ректально, как снотворное и противосудорожное средство.
Признаки острого отравления при передозировке: глубокий сон, затем наркотическое состояние, ослабление дыхания и падение сердечной деятельности.
Качественное обнаружение
Хлоралгидрат дает все реакции, которые используют для обнаружения хлороформа (см. реакции 1-4), т.к. они проводятся в присутствии щелочи, под влиянием которой хлоралгидрат разлагается с выделением хлороформа:
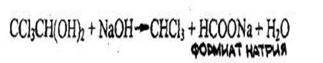
Для отличия хлоралгидрата от хлороформа используются следующие пробы:
- Реакция с реактивом Несслера
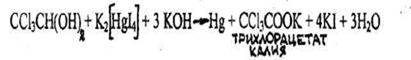
Образуется кирпично-красный осадок, который затем становится грязно-зеленым. Другие хлорпроизводные этой реакции не дают.
Реакция не специфична, ее дают альдегиды и другие восстановители.
2. Экстракция из дистиллята (при положительном результате проведённых реакций 1-4).
Часть дистиллята 2-3 раза встряхивают в делительной воронке с порциями эфира по 5 мл, эфирные вытяжки соединяют и фильтруют через сухой фильтр в фарфоровую чашку. Фильтрат выпаривают досуха при комнатной температуре под тягой. Если в дистилляте был хлороформ, то он улетучивается вместе с эфиром. При наличии хлоралгидрата в чашке остается остаток кристаллического вещества. Для подтверждения хлоралгидрата в остатке к нему прибавляют 2-Змл воды и полученный раствор подвергают исследованию при помощи вышеуказанных реакций.
4.3.2.3. ЧЕТЫРЕХХЛОРИСТЫЙ УГЛЕРОД (тетрахлорметан) ССl4
Бесцветная жидкость с резким сладковатым запахом, т. кип. 76,7 °С, образует азеотропную смесь с водой (т. кип. 66 °С, 95,9 % четыреххлористого углерода). Четыреххлористый углерод - сырье для производства хладонов, растворитель, огнетушащее средство. Четыреххлористый углерод - негорюч, взрыво- и пожароопасен. Ядовит при вдыхании, попадании внутрь через желудочно-кишечный тракт или всасывании через кожные покровы и слизистые оболочки; обладает канцерогенным, мутагенным, тератогенным, эмбриотропным действием.
Качественное обнаружение
1. Реакция отщепления хлора (методика описана выше).
2. Реакция с резорцином в щелочной среде (методика описана выше - см. 4.3.2.1)
3. Реакция образования изонитрила (методика описана выше - см. 4.3.2.2)

В отличие от хлороформа и хлоралгидрата четыреххлористый углерод не дает реакции с реактивом Фелинга, т.к. в процессе нагревания с раствором щелочи не образуется веществ, обладающих восстановительными свойствами.
Заключение о наличии четыреххлористого углерода в дистилляте делают при положительном результате реакций 1-3 и отсутствии результата реакции с реактивом Фелинга.
4.3.2.4. 1.2 -ДИХЛОРЭТАН (хлористый этилен) CICH2CH2CI
Бесцветная жидкость со сладковатым запахом; т. кип. 83,47 °С, образует азеотропную смесь с водой (т. кип. 71,6 °С, 91,8 % дихлорэтана). Используют дихлорэтан главным образом для производства винилхлорида, а также этилендиамина, этиленгликоля, полисульфидных каучуков; как растворитель, фумигант. Дихлорэтан может вызывать психические расстройства, поражения печени и почек, головокружение и рвоту при попадании внутрь или при воздействии паров в концентрациях, превышающих ПДК, равную 10 мг/м3.
Качественное обнаружение
- Реакция отщепления хлорид - ионов в жестких условиях (при длительном кипячении со спиртовым раствором щелочи или при нагревании под давлением).
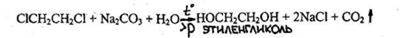
Хлорид-ион доказывают реакцией с нитратом серебра.
- Реакция образования этиленгликоля и обнаружение его после переведения в формальдегид
-
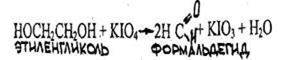
Наличие образовавшегося в процессе реакции формальдегида определяют при помощи реакции с хромотроповой или фуксинсернистой кислотами.
Чувствительность реакции 0,4 мг.
- Реакция образования ацетиленида меди
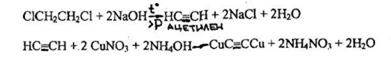
При нагревании 1,2-дихлорэтана в запаянной ампуле с раствором натрия гидроксида образуется ацетилен, который при взаимодействии с солями меди дает ацетиленид меди, имеющий розовую или вишнево-красную окраску.
Реакция специфична: другие галогенпроизводные ее не дают. Чувствительность реакции 0,25 мг.
Для отличия 1,2-дихлорэтана от хлороформа, хлоралгидрата и четыреххлористого углерода могут быть использованы изонитрильная реакция, реакция с резорцином и реактивом Фелинга, которых дихлорэтан не дает.
Реакции обнаружения хлорпроизводных, имеющих токсикологическое значение

4.3.3. АЛЬДЕГИДЫ И КЕТОНЫ
4.3.3.1. ФОРМАЛЬДЕГИД (муравьиный альдегид, метаналь) НСНО
Формальдегид представляет собой бесцветный газ с резким раздражающим запахом. Хорошо растворим в воде, спиртах и других полярных растворителях. Чистый газообразный формальдегид относительно стабилен при 80-100 °С, при температурах ниже 80 °С полимеризуется; процесс ускоряется в присутствии полярных растворителей, в том числе воды.
Формалин - водный раствор формальдегида (обычно 37 - 40 %), содержащий 6-15 % метанола (ингибитор полимеризации формальдегида). Представляет собой бесцветную жидкость с характерным острым запахом.
Формальдегид используют в органическом синтезе, в производстве синтетических смол и пластмасс, для синтеза многих лекарственных средств и красителей, для дубления кож, как дезинфицирующее, антисептическое и дезодорирующее средство.
При вдыхании воздуха, содержащего большое количество формальдегида, развиваются явления острого отравления со слезотечением, резким кашлем, чувством стеснения в груди. При приёме внутрь (в большинстве случаев ошибочном) в результате всасывания формальдегида наблюдается потеря сознания, судороги, угнетение нервных центров, раздражение почек.
Качественное обнаружение
1. Реакция с резорцином в щелочной среде
Появляется розовая или малиновая окраска.
Реакция не специфична (дают алкилгалогениды и др.).
Чувствительность 0,03 мкг.
2. Реакция с реактивом Фелинга
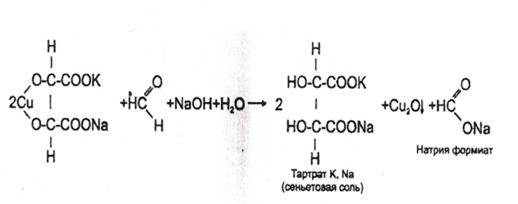
В пробирку вносят 1 мл исследуемого раствора, прибавляют 1--2 кап. 10% раствора гидроксида натрия до щелочной реакции (по лакмусу), а затем добавляют 2-3 кап. реактива Фелинга (готовится перед употреблением путем смешивания равных количеств растворов Фелинга №1 и №2). Жидкость сильно взбалтывают и нагревают. При охлаждении на дне пробирки виден желтый или красный осадок оксида меди (I).
Реакция не специфична (дают алкилгалогениды и другие). Имеет отрицательное судебно-химическое значение.
3. Реакция с фуксинсернистой кислотой (реактив Шиффа)
Появляется сине- или красно-фиолетовая окраска, иногда не сразу, а через 10-15 мин.
Чувствительность реакции 0,03 мкг.
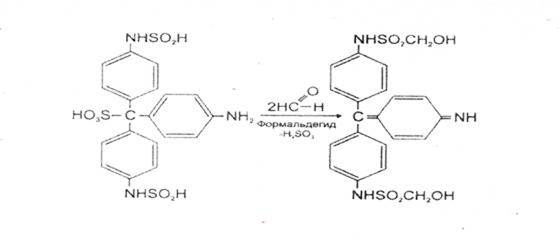
4. Реакция с кодеином и концентрированной серной кислотой
Через 5-10 мин. появляется сине – или красно-фиолетовое окрашивание.
Реакция специфична, имеет положительное судебнохимическое значение.
Чувствительность реакции 0,02 мкг.
- Реакция с хромотроповой кислотой (1,8-диоксинафталтн-3,6-дисульфокислота) в присутствии концентрированной серной кислоты
В фарфоровую чашку вносят 1 мл исследуемого раствора, а затем прибавляют 5 мл концентрированной кислоты серной и несколько кристаллов кислоты хромотроповой. Наблюдается фиолетовая или красно-фиолетовая окраска.
Реакция специфична, имеет положительное судебно-химическое значение. Чувствительность 1 мкг.
- Реакция восстановления ионов серебра (реакция «серебряного зеркала»)
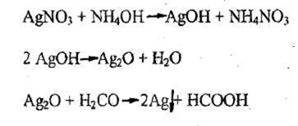
Реакция не специфична, имеет отрицательное судебно-химическое значение.
Чувствительность реакции - сотые доли микрограмма.
4.3.3.2. АЦЕТОН (2-пропанон, диметилкетон) СН3СОСН3
Ацетон представляет собой летучую бесцветную жидкость, с характерным запахом; т. кип. 56,1 °С. Смешивается с водой и органическими растворителями, например эфиром, метанолом, этанолом, сложными эфирами.
Ацетон - широко применяемый растворитель органических веществ, служит сырьем для синтеза многих соединений.
При вдыхании ацетон накапливается в организме, так как выводится из организма медленно, возможны хронические отравления. Вдыхание больше, концентраций ацетона может вызвать глубокое угнетение ЦНС, коллапс и кому. Смерть может наступить от остановки дыхания или острой сердечной недостаточности. Прием внутрь вызывает резкое раздражение слизистой оболочки желудочно-кишечного тракта, может развиться токсический гепатит, возможно нарушение функции почек. Тяжелое отравление ацетоном может развиться и при его аппликации на кожу.
Качественное обнаружение
1.Реакция образования йодоформа
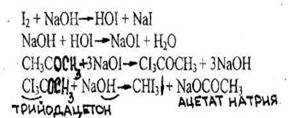
Образуется желтый осадок йодоформа.
В отличие от этанола ацетон дает реакцию в мягких условиях - без нагревания и со слабой щелочью.
Чувствительность реакции 0,1 мг. Реакция имеет отрицательное судебно-химическое значение, ее дает этиловый спирт.
1. Реакция с нитропруссидом натрия
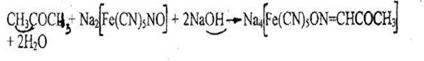
Появляется оранжево-красное окрашивание, переходящее при добавлении 10% раствора уксусной кислоты в красно-фиолетовое или вишнево-красное.
Реакция не специфична для ацетона, ее дают другие альдегиды и кетоны.
2. Реакция с фурфуролом
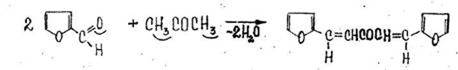
Появляется красная окраска.
Реакция не специфична для ацетона, ее дают альдегиды и кетоны.
4.3.4. ФЕНОЛ(гидроксибензол, карболовая кислота) С6Н5ОН
Фенолы - карболовая кислота, крезол, резорцин, гидрохинон. Бесцветные или окрашенные кристаллы либо аморфные вещества; часто имеют сильный характерный запах.
Фенол представляет собой бесцветные, розовеющие на воздухе кристаллы с характерным запахом; т.пл. 40,8 °С. Образует с водой двухкомпонентную азеотропную смесь (т. кип. 99,6 °С, 9,2 % по массе фенола).
Оказывают местное прижигающее, психотропное (наркотическое), нейротоксическое (судорожное), нефротоксическое действие. Смертельная доза при приеме внутрь - 2 г. Возможны отравления парами фенолов при попадании через рот или на кожу. Всасывание быстрое. При приеме внутрь фенол быстро всасывается кровью, транспортируется и распределяется по всему организму. В печени фенол подвергается биотрансформации: 10 % фенола окисляется до двухатомных фенолов (орто- и пара -соединений). При отравлении фенолом у больного темно-зелёное окрашивание мочи объясняется присутствием в ней гидрохинона и хингидрона.
Фенол относится к группе печёночных ядов. Его гепатотоксическое действие проявляется в развитии токсической дистрофии печени. Выражается в увеличении размеров печени и появления боли в печени. Также появляется желтуха, бледность, головокружение, признаки геморрагического диатеза, повышение температуры тела, нарушение психической деятельности. Церебротоксическое действие фенола проявляется печёночной энцефалопатией. Тяжелые формы отравления фенолом сопровождаются потерей сознания и печёночной комой. При попадании фенола в организм через рот наблюдаются боли в желудке, понос, иногда с кровью, рвота беловатыми, хлопьевидными массами, появляется запах фенола изо рта, моча приобретает оливковое окрашивание. На вскрытии: слизистые оболочки рта, пищевода и желудка покрыты молочного цвета пятнами, жесткими на ощупь. Отмечаются белковое и жировое перерождение паренхиматозных органов, мелкие кровоизлияния во внутренних органах и тканях мозга.
Изолирование фенола проводят методом дистилляции водяным паром. При этом фенол образует азеотропную смесь, состав которой не меняется при перегонке. При больших количествах фенола при насыщении им дистиллята ощущается характерный запах и заметны молочная муть и бесцветные или красноватые капли, растворяющиеся вследствие образования фенолята от добавления раствора натрия гидроксида. Для обнаружения в моче свободного фенола её подкисляют уксусной кислотой и подвергают перегонке с водяным паром. Дистиллят нейтрализуют бикарбонатом натрия и извлекают эфиром. При изолировании дистилляцией с водяным паром фенол выделяется в чистом виде, поэтому дополнительных методов очистки не требуется.
Для проведении анализа дистиллят делят на две части. Для одной части дистиллята проводят качественное обнаружение:
- Реакция с бромной водой (образование трибромфенола).
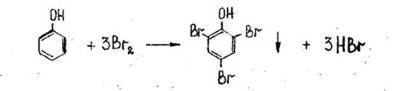
Образуется желтовато-белый осадок трибромфенола.
Чувствительность реакции 1:50000.
Реакция имеет отрицательное судебно-химическое значение, ее дают анилин и другие ароматические амины.
- Реакция образования индофенола
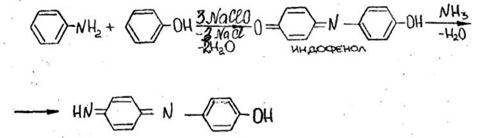
Появляется грязно-фиолетовая окраска, после прибавления раствора аммиака, переходящая в синюю (щелочная соль индофенола).
Реакция имеет отрицательное судебно-химическое значение, ее дают соединения, содержащие фенольную группу.
Часть второго дистиллята подщелачивают раствором гидрокарбоната натрия до щелочной реакции, вносят в делительную воронку и извлекают 2 мл эфира. Эфирную вытяжку упаривают при комнатной температуре досуха. Сухой остаток растворяют в 2-3 мл воды и с раствором проделывают реакции:
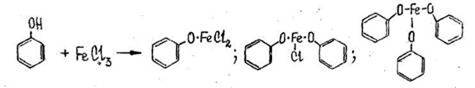
- Реакция с железа (Ш) хлоридом
Появляется сине-фиолетовая окраска, исчезающая от добавления воды, спирта и кислот (отличие от салициловой кислоты).
Чувствительность реакции 1:1000
Реакция имеет положительное судебно-химическое значение.
4.3.5.УКСУСНАЯ КИСЛОТА (этановая кислота) СНзСООН
Бесцветная прозрачная жидкость с резким запахом. Для безводной («ледяной») т.пл. 16,64 °С, т. кип. 117,8 °С. Смешивается со многими растворителями, хорошо растворяет органические соединения.
Уксусная кислота - один из главных промежуточных метаболитов, выполняющих как структурную, так и энергетическую функцию в обмене веществ.
Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей, растворы (концентрация выше 30 % по массе) при соприкосновении с кожей вызывают ожоги.
Используют в пищевой, химической промышленности, в фармации.
Химико-токсикологическое исследование на наличие уксусной кислоты проводят при специальных заданиях или при наличии соответствующих указаний в материалах делах.
Уксусную кислоту отгоняют из объектов биологического происхождения, подкисленных 10 % кислоты серной или фосфорной. Дистиллят собирают в сосуд, содержащий 0,1 моль/л раствор натрия гидроксида, ввиду летучести уксусной кислоты. Количество уксусной кислоты определяют оттитровывая кислотой избыток натрия гидроксида.
Дата добавления: 2015-08-01; просмотров: 3250;
