СЕРЕБРО
Токсикологическое значение имеет лишь серебра нитрат. Он оказывает прижигающее и вяжущее действие на кожу и слизистые оболочки. При длительной работе, как с металлическим серебром, так и с его солями может возникать аргирия (отложение металлического серебра в тканях), проявляющаяся в серо-зеленой до аспидно-серой окраске кожи и слизистых оболочек.
Отравления соединениями серебра большей частью являются случайными, но известны также случаи покушения на самоубийство с помощью серебра нитрата. Проф. А. В. Степанов в руководстве по судебной химии указывает, что предметом судебно-химического исследования неоднократно являлись краски для волос, содержавшие серебро. Соединения серебра при этом способны отчасти восстанавливаться в металлическое серебро, а также, частично разлагая содержащие серу вещества волос, переходить в черный серебра сульфид и обусловливать окраску волос. В качестве окрашивающих растворов применялись раствор серебра нитрата или аммиачный раствор серебра хлорида. Второй жидкостью, ускоряющей окраску, обычно являлся раствор натрия сульфида или аммония.
Серебро довольно широко распространено как в низших, так и в высших животных организмах. По А. О. Войнару, в органах человека обнаруживают в пересчете на 100 г свежих тканей в крови - следы, в мозгу - 0,03 мг, в печени - 0,005 мг, в легких - 0,004 мг, в костях - 0,01 мг серебра.
Естественно содержащееся в органах человека серебро не обнаруживается дробным методом анализа.
Обнаружение серебра
1. Основной реакцией при обнаружении серебра является реакция образования серебра дитизоната.
Для отличия серебра дитизоната от ртути дитизоната окрашенный хлороформный слой обрабатывают при энергичном встряхивании 1 мл 0,5моль/л раствором кислоты хлороводородной. Серебра дитизонат в этих условиях разрушается и золотисто - жёлтая окраска хлороформного слоя переходит в зелёную.
При положительном результате реакции с дитизоном серебро из минерализата выделяют в виде серебра хлорида.
2. Рекция образования серебра хлорида
Ag2SO4 + 2 NaCl ® 2 AgCl ¯ + Na2SO4
При наличии иона сереба образуется белый осадок или муть. Жидкость нагревают до кипения и осадок отделяют фильтрованием после охлаждения,
промывают его один раз водой очищенной и растворяют в 0,5 – 2,5 мл 25 % раствора аммиака.
AgCl + 2 (NH4)OH ® [Ag(NH3)2]Cl + 2 H2O
Аммиачный раствор исследуют следующим образом:
а) Каплю раствора помещают на предметное стекло, дают капле медленно (без нагревания) испариться. При наличии серебра выделяются мелкие прозрачные кристаллы в виде кубов, октаэдров, четырёхугольников. (Смотреть под микроскопом при большом увеличении).
б) К капле исследуемого раствора на предметном стекле прибавляют каплю кислоты азотной разведённой – выпадает белый творожистый осадок серебра хлорида.
[Ag(NH3)2]Cl + 2 HNO3 ® AgCl ¯ + 2 NH4NO3
в) 1 – 2 капли исследуемого раствора упаривают на предмет-ном стекле. На остаток наносят по 1 капле насыщенных растворов тиомочевины и калия пикрата. Образуются жёлтые призматические кристаллы в виде розеток пикрата тиомочевинного комплекса серебра: [AgSC(NH2)2] [C6H2(NO2)3OH].
г) 1 – 2 капли исследуемого раствора помещают на фильтровальную бумагу, на которую ранее была нанесена капля раствора FeSO4. При наличии серебра в центре пятна возникает чёрная окраска Ag (металлическое серебро), а по краям красно–оранжевое кольцо Fe3+.
[Ag(NH3)2]Cl + FeSO4 + H2O ® Ag + Fe(OH)SO4 + NH4Cl + NH3 .
ЦИНК
Токсикологическое значение. Различные соединения цинка широко применяются в промышленности, сельском хозяйстве, быту, медицине. Токсикологическое значение имеют главным образом растворимые соли цинка, например цинка хлорид, применяемый в качестве консерванта древесины и входящий в состав так называемой паяльной жидкости, а также цинка фосфид.
Цинка сульфат используется в промышленности в качестве протравы при крашении тканей и в медицине в качестве прижигающего и дезинфицирующего средства. Цинка фосфид применяется в борьбе с грызунами и неоднократно был причиной отравления домашних птиц; отмечены случаи умышленного отравления этим препаратом людей. Известны также случаи «пищевых» отравлений солями цинка вследствие приготовления или хранения пищи, особенно кислой, в оцинкованной посуде.
Смертельных отравлений соединениями цинка (цинка фосфид является исключением) в литературе не описано. Благодаря быстро наступающей рвоте при приемах внутрь солей цинка смертельная, доза сравнительно велика. По Коберту она составляет для цинка хлорида около 5 г.
При остром отравлении солями цинка наблюдаются тошнота, упорная рвота, понос, судороги. Слизистые оболочки полости рта сморщены, белые. При хронических отравлениях среди рабочих, занятых выплавкой латуни, бронзы, разработкой цинковых руд, наблюдается вызываемая вдыханием цинка «цинковая», «латунная» или «литейная» лихорадка, выражающаяся в ряде признаков заболевания и в том числе в приступах озноба и повышении температуры до 37 - 40°.
Цинк, введенный в организм, накапливается в печени и поджелудочной железе. Соли цинка выводятся главным образом через желудочно-кишечный тракт, в меньшей степени - с мочой.
Цинк поступает в организм с пищей. Является широко распространенным элементом как в неживой природе, так и в растительных и животных организмах. В органах человека, по данным А. О. Войнара, наибольшие количества цинка содержатся (в пересчете на 100 г свежего материала) в печени (5,4 -14,5 мг), почках (5,5 мг), волосах (16,3 мг) и костях 10,09 мг.
Дробным методом обнаруживается 2,73 - 6,71 мг естественно содержащегося Zn2+ в 100 г почек и 1,76 - 6,16 мг в 100 г печени, что необходимо учитывать при судебно-медицинской оценке результатов химико-токсикологического анализа.
Обнаружение цинка
При обнаружении цинка вначале проводят реакцию образования цинка дитизоната (основная реакция).
- Реакция с дитизоном
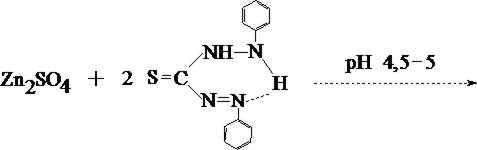
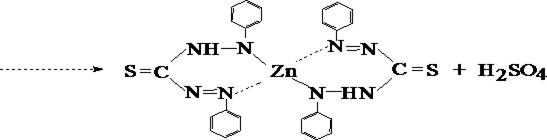
Хлороформный слой окрашивается в розово–фиолетовый цвет.
При положительном результате это реакции на цинк проводят подтверждающие реакции после выделения цинка из минерализата в виде диэтилдитиокарбамината с последующей реэкстракцией 1 моль/л раствором хлороводородной кислоты.
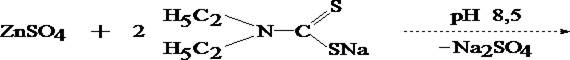
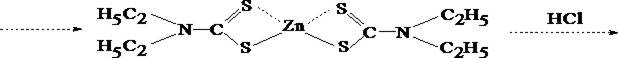
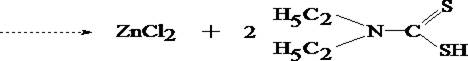
Водное извлечение отделяют, делят на три части и проделывают следующие реакции:
а) Реакция с калия гексацианоферратом (II)
ZnCl2 + K4[Fe(CN)6] 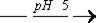 K2Zn3[Fe(CN)6]2 ¯ + 4 KCl
K2Zn3[Fe(CN)6]2 ¯ + 4 KCl
Появляется муть или белый осадок.
б) Реакция образования цинка сульфида
ZnCl2 + H2S 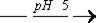 ZnS ¯ + 2 HC
ZnS ¯ + 2 HC
Образуются осадок или муть белого цвета.
в) Реакция с аммония тетрароданомеркуратом
ZnCl2 + (NH4)2 [Hg(SCN)4] ® Zn[Hg(SCN)4] ¯ + 2 NH4Cl
Появляются кристаллы в виде дендритов или одиночных клинообразных кристаллов.
МЕДЬ
Токсикологическое значение. Медь и ее соли широко применяются в промышленности. Для получения красок и в ситцепечатании используются CuO, CuCl2, Cu(NО3)2, СuСО3.Сu(ОН)2 (малахит), Cu(OCOCH3)2, Cu(OCOCH3)2.Cu(OH)2.H2О (ацетат меди основной - ярь-медянка). Сульфат меди CuSО4 применяется, кроме того, в гальванопластике, для пропитки дерева, в производстве чернил; ряд соединений меди используется в сельском хозяйстве в качестве инсектофунгицидов, например CuO, CuCl2, Cu2(OCl)2, CuSО4, CuCО3.Cu(OH)2 (последнее соединение известно под названием препарата АБ). В медицине применяются сульфат меди CuSО4. 5H2О и цитрат меди Си2С6Н4О7. 2,5Н2О.
Токсикологическое значение соединений меди невелико. Смертельной дозой сульфата меди считают 10 г.
Отравления медью в большинстве случаев являются комбинированными (медью и свинцом, медью и цинком и т. п.). При химико-токсикологических исследованиях имеет значение одновременное нахождение в объекте исследования Сu2+ и As2О5 что указывает на возможность отравления швейнфуртской (парижской) зеленью - Cu(OCOCH3)2-3Cu(AsО2)2, зеленью Шееле - Cu2AS2О5 и другими препаратами меди и мышьяка, применявшимися в сельском хозяйстве в качестве инсектофунгицидов. Объектами химико-токсикологического исследования могут оказаться рвотные массы и различные пищевые продукты, в которые медь попадает в результате приготовления пищи в плохо луженой посуде, варки в медном тазу с последующим оставлением в нем охлажденного варенья и т. п.
Широкое распространение меди в природе ведет к нахождению меди во многих растениях, например в семенах бобовых растений; медь находится и в печени, а также во внутренних органах трупов людей, особенно пожилых.
Все это указывает на особую необходимость в случае нахождения меди производить количественное определение, чтобы дать возможность судебно-медицинским экспертам и суду решить, является ли найденная медь естественной составной частью данного объекта, например зеленого горошка, внутренних органов трупа и т. д., или введена умышленно (для окраски консервов или других целей).
А. Н. Крылова определяла дробным методом медь в 100 г печени в пределах 0,56 - 1,12 мг; в почках 0,25 - 0,40 мг и в головном мозге 0,31 - 0,34 мг. Эти количества меди при судебно-медицинской оценки результатов химико – токсикологического анализа должны рассматриваться как естественно содержащиеся количества.
Обнаружение меди
Обнаружение меди основано на избирательной экстракции её из мине-рализата в виде диэтилдитиокарбамината меди с последующей реэкстракцией 1 % раствором сулемы.
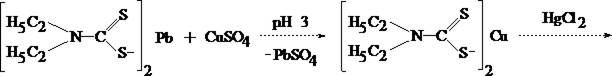
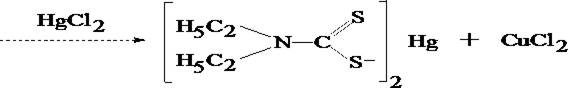
Водный слой отделяют от хлороформа, делят на три части и проделывают следующие подтверждающие реакции:
а) Реакция образования меди цинкатетрародано - меркурата
CuCl2 + 2 (NH4)2[Hg(CNS)4] + ZnSO4 ®
® Cu Zn [Hg(CNS)4]2 ¯ + 2 (NH4)Cl + (NH4)2SO4
В присутствии меди выпавший осадок окрашивается в лилово–розовый цвет.
б) Реакция образования меди - кадмия гексацианоферрата
CuCl2 + CdCl2 + K4[Fe(CN)6] ® Cu Cd [Fe(CN)6] ¯ + 4 KCl
В присутствии меди выпавший осадок окрашивается в сиреневый цвет.
в) Реакция образования пиридинроданидного комплекса меди
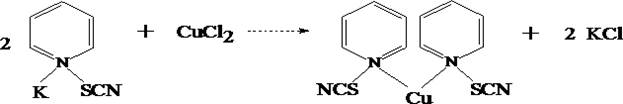
В присутствии меди хлороформ окрашивается в изумрудно–зелёный цвет.
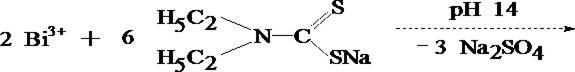
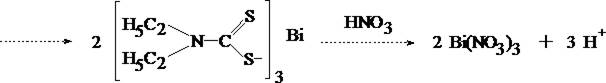
ВИСМУТ
Токсикологическое значение. Металлический висмут применяется в промышленности для получения сплавов с низкой температурой плавления. Соли висмута применяются в фотографии для изготовления косметических мазей и медицинских препаратов [BiOCI, Bi(NО3)s.5H2O, Bi(NО3)3-Bi(OH)3], светящихся со ставов [Bi(NО3)3-5H2О], в производстве хрустального стекла Bi2О3. Медицинскими препаратами висмута являются нитрат основной висмута и органические соединения висмута.
Ядовитыми свойствами обладают легко растворимые соединения висмута, применяемые в терапевтической практике в качестве противосифилитических или рвотных средств. Однако и трудно растворимые соли висмута под влиянием соляной, молочной и других органических кислот образуют легко растворимые комплексные соединения висмута, всасывающиеся в кишечнике. При введении в кровь комплексных солей наблюдались отравления висмутом. Всосавшийся висмут долго задерживается в организме, преимущественно в печени, почках, селезенке, легких, в ткани мозга, и может быть обнаружен в них по прошествии длительных сроков после его введения. Выделение висмута происходит через почки, слизистые оболочки желудочно-кишечного тракта и через потовые железы. Выделяясь потовыми железами, препараты висмута могут вызывать кожный зуд и быть причиной дерматитов.
В следах (цифровые данные в литературе отсутствуют) висмут обнаружен в органах людей как естественно содержащийся элемент.
Дробным методом естественно содержащийся висмут в печени трупа человека не определяется.
Обнаружение висмута
1. Реакция с 8–оксихинолином (основная реакция)
Bi3+ + 4 KI ® [BiI4]– + 4 K+
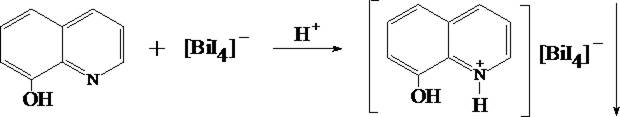
При добавлении к образовавшемуся осадку 1 мл смеси ацетона и этилацетата (1 : 1) и последующем встряхивании осадок растворяется в органическом растворителе, окрашивая последний в цвета от жёлтого до малинового.
- Реакция с тиомочевинной
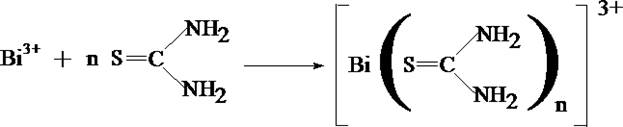
При наличии ионов висмута появляется лимонно–жёлтое окрашивание
раствора.
В случае положительного результата этих двух реакций висмут экстрагируют из минерализата в виде ДДТК–висмута.
Хлороформное извлечение отделяют, промывают водой и встряхивают с 1 мл концентрированной кислоты азотной. Азотнокислый реэкстракт отделяют и делят на 2 части, производят реакции:
а) Реакция с цезия хлоридом и калия йодидом (микрокристаллическая) Образуются оранжевые кристаллы в виде многоугольников и шестилучевых звёздCs [BiI4].
б) Реакция с калия бромидом и бруцином (микрокристаллическая)
Образуются зеленоватые игольчатые кристаллы в виде сфероидов.
[C23H26N2O4H] [BiBr4].
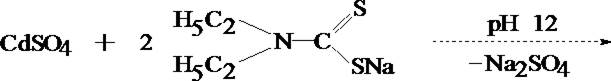
КАДМИЙ
Токсикологическое значение. Кадмий широко применяется в различных отраслях промышленности: для получения легкоплавких сплавов, изготовления электродов щелочных аккумуляторов, кадмирования, производства кадмиевых ламп, в фотографии, ювелирном деле. Кадмием заменяют олово для посуды или висмут в типографском шрифте и др.
Металлический кадмий при плавке и окись кадмия ядовиты. Кадмированная посуда может быть источником отравлений вследствие растворимости кадмия в кислых пищевых продуктах. Описаны случаи отравлений как производственного, так и бытового характера.
Соли кадмия, попавшие в желудочно-кишечный тракт, вызывают воспаление почек, жировое перерождение печени и сердца, кишечные кровотечения. Накапливается Cd2+ главным образом в печени и почках.
Смертельная доза солей кадмия, принятых через рот, для человека не установлена.
Предельно допустимая концентрация кадмия в воздухе составляет 0,0001 - 0,001 мг/м3. Количества аэрозоля окиси кадмия, равные 2500 - 2900 мг/м3, являются смертельными.
Из организма кадмий выводится очень медленно. Он постоянно встречается в растительных и животных организмах и является микроэлементом. В органах человека кадмий является естественно содержащимся элементом и постоянно обнаруживается и определяется при химико-токсикологическом анализе внутренних органов трупа человека. Т. М. Моисеева определяла естественно содержащийся кадмий в почках (0,31- 2,92 мг) и печени (0,21 - 0,42 мг) трупа человека даже при систематическом сероводородном методе анализа. Дробным методом определяется 0,64- 6,68 мг Cd2+ в 100 г печени и 1,32 - 8,48 мг Cd2+ в 100 г почек человека. Эти количества Cd2+ необходимо учитывать при судебно-медицинской оценке результатов химико-токсикологического анализа как естественно содержащиеся.
Обнаружение кадмия
Наличие кадмия подтверждают после выделения его из минерализата в виде кадмия диэтилдитиокарбамината с последующей реэкстракцией его 1 моль/л кислотой хлороводородной.

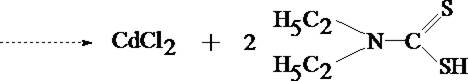
Реэкстракт используют для проведения следующих реакций.
1. Реакция образования кадмия сульфида
CdCl2 + Na2S 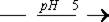 CdS ¯ + 2 NaCl
CdS ¯ + 2 NaCl
Образуется муть или осадок канареечно–жёлтого цвета.
2. Реакция образования кадмия ферроцианида
2 CdCl2 + K4[Fe(CN)6] 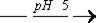 Cd2[Fe(CN)6] ¯ + 4 KCl
Cd2[Fe(CN)6] ¯ + 4 KCl
Появляется муть или осадок белого цвета.
При положительном результате этих реакций проводят микрокристаллические реакции:
а) Реакция с бруцином и натрия бромидом
В присутствии кадмия образуются бесцвет-ные призматические кристаллы в виде сфероидов:[C23H26N2O4H]2 [CdBr4].
б) Реакция с пиридином и калия бромидом
Появляются бесцветные призматические кристаллы в виде сфероидов:[C5H5N H]2 [CdBr4].
РТУТЬ
Токсикологическое значение ртути
Металлическая ртуть, а также ее соли имеют широкое и разнообразное применение в производстве люминесцентных, кварцевых и радиоламп, при изготовлении контрольно-измерительных приборов, ртутных выпрямителей, ртутных насосов. Широко используется при электролитическом способе получения хлора, калибровании химической посуды, извлечении золота и серебра из руд и для многих других солей. Из солей ртути особенно широкое применение имеет сулема, несколько меньшее – ртути нитрат, ртути сульфид, сулема, ртуть йодная и др. Широкое применение ртути и ее производных в промышленности и сельском хозяйстве делает возможным соприкосновение с ними довольно большого круга людей. Поэтому могут создаваться условия для отравления (профессиональные, медицинские, бытовые в связи с ошибочными приемами соединений ртути внутрь, при вдыхании паров ртути или ее препаратов, при передозировках и т. п.).
Характер и течение ртутных отравлений различны и зависят от способа введения ртути в организм. Пары ртути, попадая в организм через органы дыхания, поражают прежде всего, центральную нервную систему, в первую очередь кору головного мозга. Специфическое действие ртути обусловлено связыванием белковых сульфгидрильных групп, что приводит к нарушению клеточного дыхания и преципитации белков. В случаях отравления солями ртути, принятыми per os, в основном поражаются желудочно-кишечный тракт и почки, а также печень и слюнные железы, т. е. органы, через которые ртуть выделяется. При отравлении солями ртути ощущаются металлический привкус во рту, жгучие боли в пищеводе и желудке, наблюдается рвота и кровавый понос. Смертельной дозой сулемы или других растворимых солей ртути при введении в желудок считают 0,2 - 0,3 г. При внутривенном введении эта доза примерно в 2 раза меньше.
Продолжительность течения ртутной интоксикации различна. Смерть обычно наступает через 5-10 суток и позже. Из организма ртуть выводится с мочой, калом, а также железами: слюнными, потовыми, молочными и др. Выделение ртути протекает медленно. Через 2 недели после введения часть введенного количества ртути еще остается в организме.
Летальность при отравлениях препаратами ртути высокая. При отравлениях хлоридом окисной ртути она составляет 60 - 84%. В качестве противоядий при отравлениях ртутными препаратами применяют унитиол (2,3-димеркаптопролан-сульфонат натрия), и венгерский препарат дикаптол.
Ртуть откладывается в печени, почках, меньше в других органах и тканях. Она может быть обнаружена в человеческом организме и в норме.
При исследовании дробным методом печени и почек 71 трупа естественное содержание ртути в -печени определялось в пределах 0- 0,001 мг, а в почках - 0,04 мг в 100 г органа. Наибольшие количества естественно содержащейся ртути обнаруживаются в почках, несколько меньше в печени и других органах. Как естественное содержание определялось 2,4 мкг в 200 мл мочи.
Диагноз отравления соединениями ртути затруднен. Острое отравление часто принимают за желудочно-кишечное расстройство. Самым достоверным способом является химическое обнаружение и определение ртути в моче, рвотных массах, экскрементах, слюне.
Патологоанатомическая картина может дать наводящие указания лишь при типичных изменениях внутренних органов: от покраснения и набухания слизистых оболочек пищевода или желудка до некроза в виде белого или серого струпа, изменения в толстой кишке и нижних отделах тонких кишок от геморрагически-серозного воспаления до некрозов с образованием язв.
В случаях, когда отравление длилось от 5 до 14 дней, типичную картину сулемового нефроза представляют почки. Для заключения о смерти от ртутного отравления судебно-медицинскому эксперту и судебно-следственным органам существенную помощь оказывают данные химико-токсикологического анализа.
Органические препараты ртути
В последние годы широкое применение в народном хозяйстве приобрели органические соединения ртути, например этилмеркурхлорид, фенилмеркурацетат, фенилмеркурбромид и др.
Этилмеркурхлорид C2H5HgCl представляет собой белый порошок с температурой плавления 192,3° и специфическим запахом. В воде практически нерастворим, хорошо растворим в горячем спирте и 10% растворе едкого натра.
Изолирование ртутьорганических соединений из внутренних органов трупа, мочи, крови, объектов растительного происхождения (зерно) при химико-токсикологическом анализе основано на извлечении их 3 - 9 М. раствором кислоты соляной, экстракции хлороформом, качественном обнаружении и количественном (спектрофотометрическом) определении в виде этилмеркурдитизоната.
Токсикологическое значение органических препаратов ртути обусловлено как широким применением ртутьорганических соединений, так и очень высокой токсичностью их.
Многие ртутьорганические соединения, в том числе этилмеркурхлорид и препараты на его основе, широко используются в сельском хозяйстве для предпосевной обработки (протравливания) семян зерновых и других культур.
Ртутьорганические препараты применяются для пропитки стройматериалов в целях консервирования, для предохранения альбуминовых и казеиновых клеев от плесневых грибов.
В медицине некоторые ртутьорганические соединения используются в качестве диуретиков, для стерилизации инструментов, при обработке поверхности ран, в качестве противораковых средств.
В химических лабораториях с их помощью получают органические производные других элементов, решают важные теоретические проблемы химии.
По токсичности органические препараты ртути превосходят препараты неорганические. Симптомы отравления при действии органических препаратов ртути на организм не зависят от пути введения их и характеризуются острым поражением центральной нервной и сердечно-сосудистой систем.
Более высокая токсичность органических препаратов ртути объясняется тем обстоятельством, что органический радикал способствует проникновению их в липоиды мозга, что приводит к тяжелому поражению центральной нервной системы.
Клиническая картина отравлений органическими препаратами ртути не всегда характерна. Симптомы отравления часто затягиваются и напоминают желудочно-кишечные заболевания, что иногда приводило к постановке неправильного диагноза (пищевое отравление, дизентерия, туберкулезный менингит, глистная интоксикация, брюшной тиф, вирусный грипп и др.), к неправильному лечению и невозможности принять своевременные меры по спасению жизни пострадавшего. Большую помощь в диагностике отравления оказывает своевременно сделанный анализ мочи больного.
Органические препараты ртути обладают кумулятивными свойствами, долго задерживаются в организме и особенно в ткани мозга, и медленно выводятся из него. Опытами на курах и крысах было установлено, что ЭМХ хорошо всасывается из пищеварительного тракта, практически не разрушается, накапливается в печени и других жизненно важных органах, медленно и равномерно выделяется почками; с каловыми массами выделяются меньшие количества его, чем при введении неорганических препаратов ртути. Одним из путей выведения органических производных ртути являются волосы (шерсть).
Патологоанатомическая картина не всегда выявляет отравление препаратами ртути, иногда скорее напоминает отравление мышьяком, а потому судебно-медицинские эксперты для заключения о причинах смерти при подозрении на отравление ртутными препаратами обращаются к химико-токсикологическому исследованию.
Определение ртути
При изолировании ртути из биологического материала общими методами минерализации потери её за счёт улетучивания в условиях высоких температур могут достигать более 90 %. В связи с этим, проводят только частичное разрушение органических веществ, или так называемую деструкцию.
По 20 г средней пробы печени и почек раздельно (исследование смеси органов не допускается) помещают в две колбы ёмкостью 200 мл. В каждую колбу приливают 5 мл воды, 1 мл этанола, 10 мл кислоты азотной концентрированной.
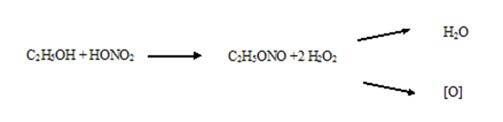

К смеси добавляют по каплям 20 мл кислоты серной концентрированной с такой скоростью, чтобы постоянно поддерживать реакцию разложения кислоты азотной, но окислы азота не выделялись из колбы. Колбу оставляют при комнатной температуре на 5 – 10 мин до прекращения выделения окислов азота, затем нагревают на кипящей водяной бане в течение 10 мин. При бурном течении реакции в колбу добавляют 30 – 50 мл воды. Горячий деструктат смешивают с двойным объёмом горячей воды и, не охлаждая, фильтруют через двойной предварительно увлажнённый фильтр в колбу, содержащую 20 мл насыщенного раствора мочевины (для связывания окислителей).
O = C (NH2)2 + 2 HNO3 ® N2 + 2 NO + CO2 + 3 H2O
O = C (NH2)2 + 2 HNO2 ® 2 N2 + CO2 + 3 H2O
Фильтр и остатки жира промывают 1 – 2 раза горячей водой. Промывные воды объединяют с деструктатом. После охлаждения жидкость разбавляют водой в мерной колбе на 200 мл и определяют ртуть.
Для обнаружения ртути в деструктате применяют реакции с дитизоном и с взвесью меди (I) йодида. Реакцию с дитизоном также применяют для фотоколориметрического определения ртути, а реакцию со взвесью меди (I) йодида используют и для визуального нефелометрического определения ртути в деструктате.
1.Реакция с дитизоном
Фотоэлектроколориметрическое определение ртути ( 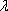 = 485 нм) по одноцветной окраске дитизоната ртути проводится после непосредственной экстракции его из деструктата четыреххлористым углеродом
= 485 нм) по одноцветной окраске дитизоната ртути проводится после непосредственной экстракции его из деструктата четыреххлористым углеродом

в CCl4_ зеленый цвет в CCl4_ оранжевый цвет
в CCl4_ зеленый цвет в CCl4_ оранжевый цвет
2. Реакция с меди (I) йодидом
Выделение ртути из деструктата проводится с использованием йодида меди (I):
Hg2+ + 4 CuI ® Cu2[HgI4] ¯ + 2 Cu+
белая розовая
взвесь взвесь
Для полного осаждения ртути вводят избыток CuI. Колориметрическое определение проводят после проведения ртути из осадка Cu2[HgI4] в растворимый комплекс К2[HgI4]
Cu2[HgI4] + 2КI/I2  К2[HgI4] + 2 CuI
К2[HgI4] + 2 CuI
В присутствии ионов ртути взвесь окрасится в розовый или красный цвет.
СУРЬМА
Токсикологическое значение В промышленности различные препараты сурьмы Sb2О5; Sb2S5 - применяются при изготовлении эмалированной по гончарных изделий, стекла, текстильных и резиновых предметов огнеупорных тканей, брезента и в других отраслях. Ряд препаратов сурьмы, как, например, пятнистая сурьма, сурьмин, стибенил, неостибозан, солюсурьмин и др., используются в медицине.
Описаны случайные медицинские, пищевые, производственные и даже умышленные отравления препаратами сурьмы.
Клиническая картина отравления сурьмой сходна с клиникой отравления соединениями мышьяка. Смертельная доза тартрата антимонилкалия для человека при введении через рот составляет ~ 150 мг.
При патологоанатомическом исследовании трупа отмечаются гиперемия легких, расстройство кровообращения, кровоизлияния в легких и органах желудочно-кишечного тракта.
Опытами на животных установлено, что сурьма может накапливаться в почках и главным образом в печени. По дани А. О. Войнара, в органах человека и млекопитающих сурьма естественно содержащийся элемент не обнаружена.
Обнаружение сурьмы
1. Реакция с малахитовым зеленым (основная реакция)
Эта реакция основана на том, что малахитовый зелёный (равно как и бриллиантовый зелёный), являющийся основным красителем, образует с ацидокомплексом сурьмы ионный ассоциат, который экстрагируется толуолом, окрашивая его в синий или голубой цвет.
Сурьма, находящаяся в минерализате в степени окисления 3+, окисляется натрия нитритом до степени окисления 5+ и с кислотой хлороводородной даёт ацидокомплекс, который и вступает в реакцию.
HSbO2 + NaNO2 + HCl ® HSbO3 + NO + NaCl + H2O
HSbO3 + 6 HCl ® HSbCl6 + 3 H2O

В присутствии сурьмы слой толуола окрашивается в сине–голубой цвет, а водный слой – в оранжевый. Толуольное извлечение отделяют, встряхивают его в течение 5 сек с 3 мл 25 % раствора кислоты серной. Голубая окраска толуольного слоя должна сохраниться.
В качестве подтверждающей реакции рекомендуется реакция образования сурьмы сульфида.
2. Реакция образования сурьмы сульфида
Sb2(SO4)3 + 3 Na2S ® Sb2S3 ¯ + 3 Na2SO4
В присутствии сурьмы появляется оранжевый осадок.
МЫШЬЯК
Токсикологическое значение
Соединения мышьяка на протяжении веков привлекали, да и сейчас продолжают привлекать внимание фармацевтов, токсикологов и экспертов-химиков. Проф. А. В. Степанов, характеризуя мышьяк как яд, отмечал, что судебная химия делала на нем свои первые шаги.
В руководствах по судебной (токсикологической) химии мышьяку всегда уделялось большое внимание. При разработке методов минерализации критерием для их оценки всегда являлось наиболее полное обнаружение и определение мышьяка (и ртути). В настоящее время, несмотря на появление большого количества веществ, представляющих токсикологический интерес, мышьяк и его соединения не утратили своего значения. Причиной этого является широкое применение различных препаратов мышьяка в народном хозяйстве и медицине и их токсичность.
Особенно велико в настоящее время значение следующих препаратов мышьяка: мышьяковистого ангидрида (AS2O3), применяемого в качестве инсектицида и консерванта в сельском хозяйстве, в стекловарении для обесцвечивания стекла, в кожевенной промышленности, медицине и т. д., а смесь натриевых солей орто - и метамышьяковистых кислот (Na3AsО3 и NaAsО2), применяемых в сельском хозяйстве в качестве инсектицидов.
Изумрудно-зеленая окраска содержимого желудков трупов животных, пищевых продуктов и других объектов исследования неоднократно являлась наводящим указанием для исследования их на наличие мышьяка и меди. Имеют токсикологическое значение и медицинские препараты мышьяка: Фаулеров раствор, натрия арсенат, миарсенол, новарсенол, осарсол и др.
Представляет токсикологический интерес и газообразный мышьяковистый водород, который может быть причиной как производственных, так и бытовых отравлений.
Соединения мышьяка издавна являлись орудиями преступления, что было связано с их повсеместной известностью, доступностью для широких слоев населения, отсутствием запаха, сладковатым вкусом таких препаратов, как, например, мышьяковистый ангидрид. Сходство картины отравления мышьяком с течением некоторых тяжелых хронических заболеваний, особенно когда небольшие дозы яда давались в течение длительного времени, приводило к тому, что отдельные преступления оставались нераскрытыми.
Причинами отравлений соединениями мышьяка в настоящее время могут быть неосторожное, небрежное или халатное отношение к хранению и применению препаратов мышьяка в народном хозяйстве, недостаточно четко поставленная техника безопасности и другие упущения. Не исключена возможность и медицинских отравлений.
Соединения мышьяка обладают как местным, так и общим действием на организм. Введенный внутрь мышьяк связывается с SH-группами ферментов и нарушает процессы окислительного фосфорилирования. Местно действует прижигающе, вызывая воспаление и омертвение тканей. На некротизирующем действии мышьяка основано применение мышьяковистого ангидрида в зубоврачебной практике.
При введении токсических доз препаратов мышьяка внутрь наступает отравление. Различают две основные формы отравления: желудочно-кишечную и нервную. Чаще наблюдается смешанная форма. При первой форме отравления появляются металлический привкус во рту, жжение в зеве, жажда, сильные боли в животе, неукротимая рвота, тяжелый понос.
При нервной форме в период от нескольких дней до нескольких недель развивается типичный мышьяковый неврит с парестезией конечностей и языка, иногда довольно стойкими параличами.
Мышьяк выделяется с мочой и калом, слюной, желчью, молоком. Процесс ускоряется под влиянием димеркаптола. Через неповрежденную кожу мышьяк и его соли не всасываются.
Смертельная доза для неорганических препаратов мышьяка составляет 0,05-0,1 г. Однако иногда и большие дозы могут не привести к смерти. Отмечают как повышенную чувствительность к мышьяку, так и привыкание к нему. Мышьяк обладает способностью кумулироваться.
Если при остром отравлении он концентрируется в основном в желудочно-кишечном тракте и паренхиматозных органах, то при хроническом отравлении накапливается преимущественно в костях и ороговевших тканях (волосы, ногти, кожа).
Патологоанатомическая картина при быстро протекающих отравлениях нехарактерна. При медленно текущих отравлениях отмечают жировое перерождение печени, почек, сердечной мышцы, местами кровоизлияния в серозных оболочках, жидкое (в виде рисового отвара) содержимое кишечника.
Мышьяк хорошо сохраняется в биологическом материале и может быть обнаружен в ней: через несколько лет после смерти.
Большое значение придают количественному определению» мышьяка в органах, так как он относится к числу чрезвычайно распространенных в природе элементов, содержится в почве, воде и т. п. При судебно-химических исследованиях эксгумированных трупов в лабораторию вместе с органами должны быть доставлены образцы земли, изъятой из шести участков с места захоронения (над гробом, под гробом, у боковых поверхностей и концов гроба), а также части одежды, украшения и доски гроба.
Содержание мышьяка в серной кислоте может привести к попаданию его в патоку и другие пищевые продукты. В животных и растительных продуктах, например в сырых плодах и овощах, мышьяк может содержаться в значительных количествах. Количество мышьяка, принимаемое человеком с пищей, в зависимости от состава ее колеблется и может достигать 1 мг в сутки. По данным Войнара, содержание мышьяка в органах человека колеблется в пределах 0,008—0,2 мг в 100 г сырого органа, а содержание мышьяка в коже и волосах может достигать 600 мг в 100 г.
В большинстве случаев результаты химико-токсикологического исследования помогают решить вопрос, в какой форме или каким путем попал мышьяк в объект исследования. Примерами этому может служить следующее:
а) совместное обнаружение в объекте исследования мышьяка и меди при отравлениях швейнфуртской зеленью;
б) одновременное нахождение мышьяка в органах эксгумированного трупа и в земле кладбища или нахождение мышьяка в органах трупа и ненахождение его в земле кладбища.
Для исследования на растворимые и, следовательно, способные проникнуть в труп соединения мышьяка из земли, находящейся вокруг гроба, 200-500 г земли последовательно извлекают водой, водным раствором аммиака и кислотой соляной. Вытяжки подвергают минерализации и исследуют на мышьяк.
в) Одновременное обнаружение мышьяка после минерализации, например, мочи, и получение азокрасителя при наличии в ней органических препаратов мышьяка. Для второй реакции 10 мл мочи подкисляют соляной кислотой, охлаждают до 0°, добавляют осторожно 4-5 капель 0,5 % раствора натрия нитрита и наслаивают 5 мл 1% раствора резорцина - красное кольцо на границе слоев указывает на наличие в исследуемом материале аминогруппы.
г) Обнаружение в объекте исследования крупинок мышьяковистого ангидрида. Крупинки мышьяковистого ангидрида трудно растворимы в воде, возгоняются, давая кристаллические возгоны (тетраэдры и октаэдры), а при нагревании с углем восстанавливают до металлического мышьяка. Растворы кислоты соляной дают и другие качественные реакции на ион мышьяка.
Обнаружение мышьяка
Применяемые в химико – токсикологическом анализе методы обнаружения мышьяка основаны на переведении его в гидрид мышьяка и на последующем определении гидрида мышьяка при помощи реакций Зангер – Блека и реакции Марша. При этих реакциях из соединений мышьяка выделяется гидрид мышьяка, который летуч и ядовит. Поэтому при выполнении данных реакций требуется особая осторожность.
Классическими методами обнаружения мышьяка при химико- токсикологическом анализе является: метод Марша, предложенный английским химиком Джеймсом Маршем 1836 г.
Достоинствами способа являются:
1) возможность многократной проверки наличия или отсутствия мышьяка в исследуемой пробе;
2) наглядность, доказательность, специфичность.
В то же время обнаружение мышьяка по методу Марша требует затраты значительного количества времени эксперта–химика – более 3-х часов.
Поэтому в качестве ориентирующей реакции, имеющей только отрицательное значение, в дробном обнаружении мышьяка введена реакция Зангер – Блека, проведение которой осуществляется в течение 60 мин.
Реакция Зангер – Блека неспецифична для мышьяка, что ограничивает значение её в токсикологической химии, но высокочувствительна. Чувствительность реакции достигает 0,1 мкг мышьяка в исследуемом объёме. При отрицательном результате этой чувствительной реакции отпадает необходимость в проведении реакции Марша. При положительном результате, подтверждение обнаружения мышьяка реакцией Марша является обязательным.
Реакция Зангер – Блека позволяет сочетать качественное обнаружение мышьяка (при его малых количествах) с полуколичественным определением. Метод основан на восстановлении соединений мышьяка до гидрида мышьяка, который затем реагирует с хлоридом или бромидом ртути (II). Реакция выполняется в специальном приборе (рис. 1).
Восстановление соединений мышьяка производится водородом в момент его выделения, который получают при взаимодействии металлического цинка с кислотой серной:
H2SO4 + Zn ® ZnSO4 + 2 H
Металлический цинк и кислота серная, применяемые для получения водорода должны быть судебнохимически чистые (схч), т.е. не содержать мышьяка.
Для ускорения реакции между цинком и кислотой серной применяют «купрированный» цинк. Куприрование осуществляется погружением цинка на несколько минут (до потемнения цинка) в 0,05 % раствор меди (II) сульфата с последующим промыванием водой. Куприрование необходимо потому, что чистый цинк плохо реагирует скислотой серной.
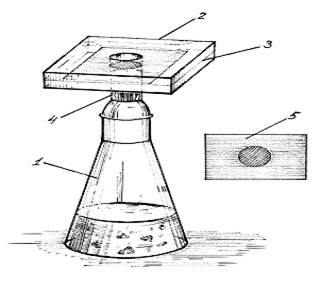
Рис. 1. Прибор Зангер – Блека
1 – колба;
2 – насадка с тампоном ваты, пропитанной раствором свинца ацетата;
3 – бумага, обработанная раствором ртути (II) хлорида;
4 – ватный тампон;
5 – проявленная реактивная бумага.
Водород, образовавшийся при взаимодействии кислоты серной и цинка, восстанавливает соединения мышьяка до арсина (AsH3).
AsO2– + 7 H+ ® AsH3 + 2 H2O
AsO33– + 9 H+ ® AsH3 + 3 H2O
AsO43– + 11 H+ ® AsH3 + 4 H2O
Скорость восстановления соединений трёх– и пяти–валентного мышья-ка (арсенитов и арсенатов) водородом различна. Арсениты восстанавливаются водородом легче, чем арсенаты. В присутствии солей железа (II) или олова (II) арсенаты легко восстанавливаются в арсениты.
AsO43– + Sn2+ + 4 H+ ® AsO2– + Sn4+ + 2 H2
AsO2– + 7 H+ ® AsH3 + 2 H2O
Образовавшийся гидрид мышьяка реагирует с хлоридом или бромидом ртути (II), которым пропитана фильтровальная бумага. В результате этой реакции образуется ряд окрашенных соединений, которые окрашивают бумагу в виде жёлтого или коричневого пятна:
AsH3 + HgCl2 ® AsH2(HgCl) + HCl
AsH3 + 2 HgCl2 ® AsH (HgCl) 2 + 2 HCl
AsH3 + 3 HgCl2 ® As (HgCl) 3 + 3 HCl
AsH3 + As(HgCl)3 ® As2Hg3 + 3 HCl
Сероводород, выделяющийся при взаимодействии водорода с кислотой серной реагирует с хлоридом или бромидом ртути (II). В результате этой реакции образуется ртути (II) сульфид тёмно–коричневого цвета, который маскирует, имитирует окраску пятен. Для связывания сероводорода применяют вату, пропитанную раствором свинца ацетата:
H2S + Pb(CH3COO)2 ® PbS + 2 CH3COOH
В колбу прибора Зангер – Блека (рис. 1) вносят 4 мл минерализата, 10 мл 25 % раствора серной кислоты, 5 мл воды, 1 мл 10 % раствора олова (II) хлорида в 50 % растворе серной кислоты и 6 – 8 гранул купрированного цинка. Колбу закрывают насадкой, в которую вложена бумага, пропитанная ртути хлоридом, а ниже вставлен тампон ваты, пропитанный раствором свинца ацетата. Через 60 мин реактивную бумажку извлекают, отмечают окраску пятна. В зависимости от количества мышьяка, находящегося в объекте исследования, бумажка окрашивается в цвета от светло–жёлтого до тёмно–коричневого.
Реакция Марша основана на восстановлении соединений мышьяка водородом в момент его выделения и на последующем термическом разложе-нии образовавшегося при этом гидрида мышьяка:
AsO2– + 7 H+ ® AsH3 + 2 H2O
2 AsH3  2 As + 3 H2
2 As + 3 H2
Обнаружение мышьяка проводится на приборе Марша (рис. 2). Прибор Марша в современном варианте состоит из нескольких частей: конической колбы ёмкостью 150 мл, к горлу которой пришлифована капельная воронка и стеклянная трубка, согнутая под прямым углом; хлор–кальциевой трубки; восстановительной трубки, обычно называемой трубкой Марша. Восстановительная трубка изготавливается из тугоплавкого стекла или кварца и имеет в нескольких местах сужения (диаметр 1,5 мм), при внутреннем диаметре трубки 4 – 5 мм, а конец её согнут почти под прямым углом и оттянут.
Работа на приборе Марша включает три этапа.
1. Сборка прибора и вытеснение из него воздуха водородом
В колбу прибора Марша помещают 10 г купрированного цинка. В хлоркальциевую трубку помещают безводный гранулированный кальция хлорид, который предназначен для осушения водорода и арсина (AsH3), выходящих из колбы. Колбу, хлоркальциевую и восстановительную трубки соединяют друг с другом (встык) резиновыми трубками. Собранный таким образом прибор Марша должен быть герметичным. В капельную воронку прибора наливают 20 мл 10 % раствора кислоты серной, которую небольшими порциями (по 4 – 5 мл) приливают к «купрированному» цинку. В капельной воронке необходимо оставлять 8 – 10 мл раствора кислоты серной, которая препятствует попаданию воздуха в прибор Марша. Воздух может быть причиной взрыва прибора при нагревании восстановительной трубки или при зажигании выходящих из неё газов. В течение 15 – 20 мин из прибора вытесняют воздух. Чтобы убедиться в полноте вытеснения воздуха водородом из прибора Марша, над выходным отверстием восстановительной трубки помещают узкую пробирку донышком вверх. Через 4 – 5 мин пробирку закрывают пальцем и, не переворачивая её, относят от прибора и зажигают. В случае, если воздух из прибора вытеснен, водород вспыхивает без взрыва (без хлопка).
2. Проверка прибора и реактивов на отсутствие мышьяка
После удаления воздуха из прибора приступают к проверке наличия мышьяка в реактивах (кислоте серной, цинке) и посуде. Для этой цели:
а) зажигают водород у открытого конца восстановительной трубки. При наличии мышьяка пламя приобретает синеватую окраску;
б) восстановительную трубку в широкой части её нагревают до слабо–красного каления, а суженное место восстановительной трубки за нагреваемым широким участком охлаждают. Через час проверяют охлаждаемую часть восстановительной трубки на отсутствие буровато–серого налёта металлического мышьяка.
При отрицательных результатах испытания аппарата и реактивов в течение часа переходят к исследованию минерализата.
3. Исследование минерализата
Смешивают  часть минерализата с 1 – 2 мл 10 % раствора олова (II) хлорида в серной кислоте (1 : 3) и жидкость переносят в капельную воронку. Постепенно жидкость вводят в колбу.
часть минерализата с 1 – 2 мл 10 % раствора олова (II) хлорида в серной кислоте (1 : 3) и жидкость переносят в капельную воронку. Постепенно жидкость вводят в колбу.
В процессе исследования в приборе Марша проводят ряд реакций и наблюдений.
1. Отставив горелку от нагретой части трубки и охладив её, наблюдают, не окрашено ли пламя у конца восстановительной трубки в синеватый цвет, характерный для мышьяковистого водорода; не ощущается ли запах чеснока, не появляется ли буровато–серый налёт при внесении холодных частей фарфоровой пластинки в пламя восстановительной трубки.
2. Пламя водорода восстановительной трубки тушат и к отверстию оттянутого конца подносят фильтровальную бумагу, смоченную 2 – 5 % раствором серебра нитрата. Наблюдают, не появится ли почернение бумаги в результате образования металлического серебра:
AsH3 + 3 AgNO3 ® AsAg3 + 3 HNO3
AsAg3 + 3 AgNO3 ® AsAg3 × 3 AgNO3
AsAg3 × 3 AgNO3 + 3 H2O ® 6 Ag + H3AsO3 + 3 HNO3
Горелку вновь подставляют под трубку Марша и продолжают исследование в течение часа. По истечении указанного времени смотрят, не появилось ли серовато–бурого налёта с металлическим блеском в охлаждаемой части восстановительной трубки. Если значительный тёмный налёт образуется раньше, то не обязательно нагревать в течение часа.
Исследование тёмного налёта. В случае получения плотного налёта, его подвергают дополнительному исследованию, т.к. налёты могут давать и другие вещества (сурьма, селен, сера, уголь и др.). Для чего восстановительную трубку отсоединяют от прибора Марша и место налёта осторожно нагревают. Металлический мышьяк и сурьма при этом окисляются и откладываются в виде белого налёта оксидов (As2O3 и Sb2O3) в холодных местах восстановительной трубки. При рассматривании налёта под микроскопом при наличии мышьяка видны характерные кристаллы мышьяковистого ангидрида As2O3 в виде октаэдров (рис. 3), а оксид сурьмы аморфный. Образование кристаллов октаэдрической формы является одним из важнейших доказательств наличия мышьяка в минерализате, а микрофотография кристаллов может служить доказательством правильности выводов эксперта–химика об обнаружении мышьяка в объектах исследования.
В случаях, когда налёт мышьяковистого ангидрида в трубке Марша не имеет ясно выраженного кристаллического строения, что бывает при количествах мышьяка менее 0,05 мг, поступают следующим образом: налёт мышьяковистого ангидрида растворяют в 2 – 3 каплях 50 % раствора кислоты азотной и переносят на предметное стекло. Раствор осторожно упаривают досуха. Сухой остаток растворяют в 1 – 2 каплях 10 % раствора кислоты хлороводородной, в раствор вносят 1 – 2 кристалла цезия хлорида (CsCl), а затем, через некоторое время, если никакого осадка не появилось (отсутствие сурьмы), добавляют несколько кристаллов калия йодида – при наличии мышьяка выпадает ярко–красный осадок: Cs2AsI5 × 2,5 H2O, имеющий под микроскопом вид шестилучевых звёздочек и шести-угольников. Кристаллы Cs2AsI5 × 2,5 H2O по своему виду напоминают Cs2SbI5 × 2,5 H2O.
При действии пиридина на красный осадок Cs2AsI5 × 2,5 H2O последний растворяется, а по краям образуются зеленовато–жёлтые игольчатые кристаллы. При наличии сурьмы кристаллы Cs2SbI5 × 2,5 H2O теряют окраску, но сохраняют форму (рис. 3).
Рис. 3. Микрокристаллические реакции на мышьяк и сурьму
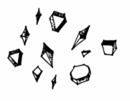
Кристаллы мышьяковистого ангидирида

Мышьяк с цезия хлоридом.

Сурьма с цезия хлоридом

Мышьяк после обработки пиридином

Сурьма после обработки пиридином
Дата добавления: 2015-08-01; просмотров: 3654;
