ДРОБНОЕ ОБНАРУЖЕНИЕ, ОПРЕДЕЛЕНИЕ И ТОКСИКОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ ОТДЕЛЬНЫХ КАТИОНОВ
СВИНЕЦ
Токсикологическое значение свинца
Токсикологическое значение свинца определяется ядовитыми свойствами металлического свинца, его солей и некоторых производных: широким и разнообразным применением их в промышленности и быту.
Из различных соединений свинца наибольшее токсикологическое значение имеют арсенат, ацетат, хромат, карбонат, хлорид, нитрат и ряд других солей этого металла. Оксид свинца применяется для приготовления некоторых красок, входит в состав свинцового пластыря. Свинца карбонат является одним из компонентов свинцовых белил. В состав некоторых красок входит и свинца хромат. Свинца арсенат относится к числу соединений, применяемых для борьбы с вредителями садов и виноградников. Основной свинца ацетат в ряде стран применяется и медицине. Стеарат, олеат и другие соединения свинца с органическими кислотами используются в качестве стабилизаторов при получении пластмасс. Эти соединения используются как добавки к краскам, а также входят в состав некоторых помад и жидкостей для волос.
Особенно опасными в отношении отравлений свинцом являются добыча свинцовых руд, выплавка свинца, производство аккумуляторов, свинцовых красок [свинцовые белила 2РbСО3.Рb(ОН)2 и сурик Рb3О4], применение которых в России ограничивается только окраской судов и мостов, лужение, пайка, применение свинцовой глазури PbSiО3 и т. д. При недостаточной охране труда возможны промышленные отравления.
Источниками бытовых отравлений являлось в ряде случаев недоброкачественно луженая (при употреблении консервов, изготовленных в недоброкачественно луженной посуде), эмалированная, фарфорово-фаянсовая и глиняная посуда, покрытая глазурью. Описаны случаи отравления свинцом через питьевую воду (свинцовые трубы), нюхательный табак, завернутый в свинцовую бумагу, после огнестрельного ранения и т.п. Более известны также случаи отравлений свинцовыми солями и тетраэтилсвинцом.
Основным источником отравлений соединениями свинца является поступление их в пищевой канал.
Ионы свинца, поступившие в организм, соединяются с сульфгидрильными и другими функциональными группами ферментов и некоторых других жизненно важных белковых соединений. Около 90 % ионов свинца, поступивших в кровь, связываются эритроцитами (по Р. Лудевигу и К. Лосу, 1983).
Свинец является протоплазматическим ядом, вызывающим изменения главным образом в нервной ткани, крови и сосудах. Ядовитость соединений свинца в значительной степени связана с растворимостью их и в желудочном соке, и в других жидкостях организма. Хроническое отравление свинцом дает характерную клиническую картину. Смертельная доза различных соединений свинца неодинакова. Дети особенно чувствительны к нему.
Свинец поражает все отделы головного мозга, особенно гипоталамические отделы и ретикулярную формацию ствола. Свинец блокирует ферменты, участвующие в синтезе гема. Развивается гипохромная анемия при нормальном содержании железа сыворотки. Кроме того, свинец повышает гемолиз эритроцитов.
Свинец не относится к числу биологических элементов, но обычно присутствует в воде и пище, откуда поступает в организм. Человек, не занятый работой со свинцом, поглощает в сутки, как указывает Н. В. Лазарев, 0,05 - 2 г свинца (в среднем 0,3 мг). Соединения свинца способны кумулироваться в костной ткани, печени, почках. Около 10% его всасывается организмом, остальное количество выделяется с калом. Свинец откладывается в печени и в трубчатых, несколько меньше в плоских костях. В остальных органах откладывается в незначительном количестве. Отсюда необходимость обнаружения свинца во внутренних органах трупов людей, умерших от других причин, и обязательное количественное определения его при положительных результатах качественного анализа.
Естественное содержание свинца (по данным А. О. Войнара, в миллиграммах на 100 г органа) в печени 0,130; в почке 0,027; в трубчатых костях 1,88; в желудке и кишечнике 0,022 и 0,023 соответственно.
Соединения свинца выделяются из организма главным образом с калом. Меньшие количества этих соединений выделяются с желчью, а следовые количества - с мочой. Соединения свинца частично откладываются в костной ткани в виде трехзамещенного фосфата.
Патологоанатомическая картина в острых случаях общая для соединений тяжелых металлов.
Клиническая картина. Острое отравление - головная боль, слабость, головокружение, рвота, брадикардия, артериальная гипотензия, потливость, слюнотечение, зуд, парестезии, тремор конечностей. Симптомы часто развиваются через 6 ч - 2 сут после отравления. При вдыхании паров более выражена неврологическая симптоматика: бессонница, головная боль, атаксия, судороги, галлюцинации, психомоторное возбуждение. При пероральном приеме - диспептические расстройства: жажда, отрыжка, боль в животе, тошнота, рвота, диарея. У детей в течение 1-5 дней - стойкая неукротимая рвота, атаксия, судороги, нарушения сознания.
Хроническое отравление, Возможно возникновение тремора конечностей, повышенной утомляемости, раздражительности, расстройств памяти, бессонницы. Дискомфорт в области живота, рвота, снижение массы тела, гипотрофия мышц. Возможно развитие почечной недостаточности.
Тяжелая интоксикация (острая или хроническая): алиментарный синдром - анорексия, привкус металла (при хронической интоксикации - ощущение волоса) во рту, запоры, кишечные колики, напряжение мышц брюшной стенки (иногда), на дёснах - свинцовая (сине-черная) кайма. Нервно-мышечный синдром (чаще у взрослых): безболезненный периферический неврит и слабость мышц-разгибателей. При хроническом отравлении - свинцовая энцефалопатия (чаще у детей) с эпилептиформными припадками, коматозное состояние; долговременные остаточные явления, включающие неврологические дефекты (нейроциркуляторная триада - артериальная гипотензия, брадикардия, гипотермия), психопатологические расстройства (упорные головные боли, бессонница, повышенная возбудимость, беспокойный сон с кошмарами), задержка умственного развития (у детей). При остром отравлении - галлюцинации, бред, психомоторное возбуждение, маниакальный синдром, судороги.
Беременность. Отравление свинцом во время беременности приводит к рождению недоношенных детей и преждевременному родоразрешению. Свинец обладает тератогенными свойствами.
Исследование осадка
При решении вопроса об отравлении тетраэтилсвинцом (С2Н5)4Рb применяют специальную методику, основанную на изолировании этого яда перегонкой с водяным паром.
Выше было обосновано, что при разбавлении минерализата водой возможно появление мути или выпадение осадка. Это означает, что в минерализате находится белый осадок свинца сульфата. Такого же цвета осадок бария сульфата образуется при отравлении соединениями бария. В результате соосаждения осадки сульфатов свинца и бария могут быть загрязнены ионами кальция, хрома, железа и др. При наличии хрома в осадке он имеет грязно-зеленую окраску. Химико–токсикологический интерес представляют только барий и свинец, которые необходимо до обнаружения разделить.
Оптимальными условиями для количественного осаждения Ва2+ и Рb2+ являются: концентрация в минерализате ~20 % H2SO4, отсутствие окислов азота (частичное растворение PbSО4 и в значительно меньшей степени BaSО4 в кислоте азотной), время осаждения (~24 часа). Вследствие соосаждения в осадке могут также находиться Са2+, Fe3+, Al3+, Cr3+, Zn2+, Cu2+ и др. При соосаждении Сr3+ осадок окрашен в грязно-зеленый цвет. Во избежание потерь Сr3+ грязно-зеленый осадок обрабатывают при нагревании раствором персульфата аммония в 1% растворе серной кислоты. Нерастворившийся осадок подвергают анализу на Ва2+ и Рb2+, а фильтрат оставляют для количественного определения хрома.
Исследование фильтрата на свинец
а) реакцией с дитизоном (H2Dz)
К раствору, содержащему свинца ацетат, прибавляют хлороформный раствор дитизона и взбалтывают. При этом образуется однозамещенный дитизонат свинца Pb(HDz)2, хлороформный раствор которого имеет оранжево-красную окраску:
В зависимости от объема водного слоя раствор исследуют далее микрокристаллическими или макрохимическими реакциями.
При малом объеме водного слоя
а) получают двойную соль йодида цезия и свинца - Cs[PbI3]
(CH3COO)2Pb + CsCl + 3 KI ® Cs[PbI3] ¯ + KCl + 2 CH3COOK
При наличии ионов свинца образуются прозрачные игольчатые кристаллы на жёлтом фоне.
б) образование гексанитрита калия, меди и свинца K2Cu[Pb(NO2)6]
(CH3COO)2Pb + (CH3COO)2Cu + 6 KNO2 ® K2Cu[Pb(NO2)6] ¯ + 4 CH3COOK
Образование чёрных или коричневых кристаллов, имеющих форму куба, указывает на наличие ионов свинца.
При большом объеме водного слоя (2 мл и более)
а) образования PbS:
(CH3COO)2Pb + Na2S = PbS¯ + 2 CH3COO Na
При наличии ионов свинца появляется чёрный осадок.
Осадок не растворяется в разбавленных серной и соляной кислотах, но растворяется в разбавленной кислоте азотной с выделением окислов азота и элементарной серы:
3PbS + 8HNО3 = 3Pb(NО3)2 + 2NO + 3S + 4H2О;
б) образование PbSО4:
(CH3COO)2Pb + H2SO4 ® PbSO4 ¯ + 2 CH3COOH
При наличии ионов свинца появляется белый осадок
Осадок свинца сульфата растворяется в концентрированной серной кислоте с образованием кислой соли:
PbSО4 + H2SО4 = Pb(hso4)2
При добавлении воды вновь выпадает осадок сульфата свинца.
в) образования РbСrО4: нерастворим в уксусной кислоте, но растворим в минеральных кислотах и едких щелочах:
2 (CH3COO)2Pb + K2Cr2O7 + H2O ® 2 PbCrO4 ¯ + 2 CH3COOK + 2 CH3COOH
При наличии ионов свинца появляется оранжево–жёлтый осадок.
г) образования PbI2:
(CH3COO)2Pb + 2 KI ® PbI2 ¯ + 2 CH3COOK
При наличии ионов свинца выпадает жёлтый осадок, который растворяется при нагревании и вновь появляется при охлаждении (в избытке реактива осадок растворяется).
БАРИЙ
Токсикологическое значение
Из соединений бария токсикологическое значение имеют его гидроксид, хлорид, нитрат, карбонат, хлорат и др. Все растворимые соли бария ядовиты. Соединения бария применяю для получения препаратов бария, в керамическом и стекольном производстве (ВаСОз), в текстильной и резиновой промышленности, в сельском хозяйстве (ВаС12) для борьбы с вредителями растений; селенит бария (BaSeО3) и бария карбонат применяют для дератизации. Некоторые препараты бария, например бария хлорид, гидрат окиси бария, имеют применение в аналитических лабораториях. Бария сульфат, применяемый при рентгеноскопии, практически нетоксичен. Смерть наступает от паралича сердца.
В истории отравлений барием различают два периода: первый - до введения бария сульфата в качестве контрастного вещества при рентгенологическом исследовании желудочно-кишечного тракта, второй - после введения бария сульфата в рентгеноскопию. В первом периоде отравления соединениями бария были редкими. Причиной их было применение бария карбоната в смеси с мукой для отравления крыс или бария хлорида для аппретуры белья. С момента внедрения бария сульфата в медицинскую практику отравления солями бария стали встречаться чаще. Причиной этих интоксикаций, как правило, является бария сульфат, нерастворимый в воде и в жидкостях организма, а растворимые соли его, содержащиеся в бария сульфате в виде примесей, или ошибочное применение растворимых солей бария вместо бария сульфата. Известны случаи отравления бария карбонатом, находящимся в бария сульфате в виде примесей. Такие отравления объясняются тем, что для рентгеноскопии используют большие (до 100 г и более) количества бария сульфата, который по способу своего получения может содержать бария карбонат, переходящий в организме под влиянием соляной кислоты желудочного сока в растворимый бария хлорид.
При приеме внутрь ядовитых соединений бария возникают жжение во рту, боли в области желудка, слюнотечение, тошнота, рвота, головокружение, мышечная слабость, одышка, замедление пульса и падение артериального давления. Основной метод лечения отравлений барием - промывание желудка и употребление слабительных средств. Основными источниками поступления бария в организм человека являются пища (особенно морепродукты) и питьевая вода. По рекомендации Всемирной организацией здравоохранения содержание бария в питьевой воде не должно превышать 0,7 мг/л, в России действуют гораздо более жесткие нормы - 0,1 мг/л.
Соединения бария оказываются нейротоксическое (паралитическое), кардиотоксическое, гемотоксическое действия. Основные симптомы: жжение во рту и пищеводе, боли в животе, тошнота, рвота, диарея, головокружение; кожные покровы бледные, покрыты холодным потом. Пульс медленный, слабый; экстрасистолия, мерцание предсердий, возможна остановка сердца; снижение АД; одышка, цианоз. Через 2-3 ч после отравления - нарастающая мышечная слабость (особенно мышц верхних конечностей и шеи), иногда гемолиз.
Соединения бария выделяются из организма главным образом через кишечник. Следовые количества этих соединений выводятся через почки и частично откладываются в костях. Сведения о содержании бария как нормальной составной части клеток и тканей организма в литературе отсутствует.
Патологоанатомическая картина неспецифична: наблюдаются гиперемия и кровоизлияния в слизистой оболочке желудка, кишках, серозных покровах и в легких, жировое перерождение печени. Химико-токсикологическое исследование оказывает серьезную помощь в диагностике отравлений. Выделение бария происходит главным образом через желудочно-кишечный тракт. Ва2+ в незначительных количествах содержится во всех органах и тканях живых существ в качестве естественной составной части организма (А. О. Войнар).
Исследование фильтрата на барий
1. Реакция перекристаллизации BaSО4 из концентрированной кислоты серной.
Часть исследуемого осадка на фильтре переносят на предметное стекло и слегка подсушивают. Затем к осадку прибавляют 2 капли концентрированной кислоты серной и осторожно нагревают до появления паров. (Кислота серная не должна растекаться на предметном стекле). При наличии в осадке бария сульфата на стекле через 15 – 20 мин после охлаждения появляются бесцветные кристаллы, имеющие форму квадратов с вытянутыми углами или в виде мелких крестов и прямоугольных пластинок.
2. Реакция образования бария йодата
BaSO4 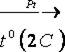 BaS + 2 CO2
BaS + 2 CO2
BaS + 2 HCl ® BaCl2 + H2S
BaCl2 + 2 KIO3 ® Ba(IO3)2 + 2 KCl
На предметное стекло наносят несколько капель 10 % раствора кислоты хлороводородной. Затем платиновой петлёй забирают часть исследуемого осадка и нагревают его в восстановительной части пламени горелки. При этом бария сульфат восстанавливается в бария сульфид, а пламя горелки окрашивается в зелёный цвет.
При исследовании больших количеств осадка и при поступлении на химико–токсикологический анализ химических соединений бария возможно проведение дополнительных подтверждающих реакций.
3. Реакция с калия бихроматом
2 BaCl2 + K2Cr2O7 + H2O 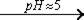 2 BaCrO4 ¯ + 2 KCl + 2 HCl
2 BaCrO4 ¯ + 2 KCl + 2 HCl
Выпадает жёлтый кристаллический осадок.
4. Реакция с кислотой серной
BaCl2 + H2SO4 ® BaSO4 ¯ + 2 HCl
Выпадает белый кристаллический осадок.
5. Реакция с натрия родизонатом
В присутствии катиона бария на бумаге появляется красновато–коричневое пятно не исчезающее от добавления капли кислоты хлороводородной (отличие от стронция).
Объектами исследования на наличие бария могут быть не только органы трупов и биологические жидкости, но и химические соединения этого металла, которые в народном хозяйстве широко используются для борьбы с вредителями сельскохозяйственных культур и для других целей.
Дата добавления: 2015-08-01; просмотров: 2762;
