Применение диэтилдитиокарбаминовой кислоты и её солей
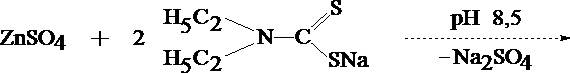
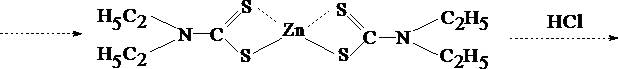
Диэтилдитиокарбаминовая кислота - соединение, неустойчивое в водных растворах, поэтому в аналитической практике используют её натриевую, аммониевую, свинцовую соли. Эти реагенты образуют более чем с 20 металлами внутрикомплексные соединения – диэтилдитиокарбаминаты (ДДТК металлов). В большинстве случаев они используются для целей селективной экстракции катионов из минерализата.
Свойства ДДТК металлов
ДДТК металлов, за исключением ДДТК натрия, нерастворимы в воде, но хорошо растворяются в органических растворителях (хлороформ). Большинство ДДТК металлов - бесцветные соединения. Окраску имеют некоторые растворы комплексных соединений в хлороформе: ДДТК меди имеют яркое желто-коричневое окрашивание, ДДТК висмута, кадмия, сурьмы – бледно - желтое, хрома - бледно-зеленое.
ДДТК металлов образуются при строго определенных значениях pH среды. В щелочной среде образуются комплексы цинка (рН 8,5), кадмия (рН 12,5), висмута (рН 14). Оптимальным значением рН для образования ДДТК меди является рН 3, однако этот комплекс устойчив и в интервале рН от 4 до 11. Таким образом, регулируя рН раствора, можно избирательно изолировать из минерализата тот или иной катион.
Устойчивость ДДТК металлов также связана с рН среды; те комплексы, которые образуются в щелочной среде - неустойчивы в кислой и разрушаются под действием кислот. Это свойство используется для реэкстрации металлов из их комплексов и переведения в водную фазу с целью проведения подтверждающих реакций. Например, ДДТК цинка и кадмия можно разрушить действием кислоты хлористоводородной, а ДДТК висмута - азотной.
Для тех ДДТК металлов, которые устойчивы в широком интервале рН (медь), выделение катиона в водную фазу основано на использовании правила рядов среди диэтилдитиокарбаминатов. Согласно этому правилу каждый предшествующий катион, находящийся в водной фаз, вытесняет последующие катионы из их комплексов, растворенных в хлороформе.
Ряд ДДТК токсикологически важных катионов можно представить следующим образом:
Нg > Аg > Си > Ni > Со > Pb > Bi > Cd > Tl > Sb > Zn > Mn > Fe
Например, Нg 2+ способна вытеснять Си из (ДДТК)2Си, в свою очередь Си 2+
вытесняет Pb из (ДДТК)2 Pb.
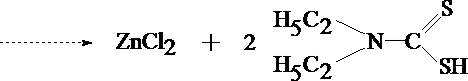
Катионы цинка, кадмия, висмута и меди называют экстракционными катионами и их анализ проводят по следующей схеме:
1. Выделение из минерализата в виде комплекса с ДДТКК при определенном рН раствора и экстракция в органическую фазу.
2. Разрушение комплексов кислотами или по правилу рядов – реэкстракция - переведение катионов в водную фазу.
3. Обнаружение и количественное определение.
Дата добавления: 2015-08-01; просмотров: 1888;
