МАРГАНЕЦ
Токсикологическое значение марганца. В последние годы соединения марганца приобретают все большее значение в различных областях промышленности: металлургической, стекольной при изготовлении глазури и эмали, химической, ситцепечатании и др. Применяют также некоторые соединения марганца (КМnО4) в медицине и в санитарии.
Соединения марганца являются сильными протоплазматическими ядами, особенно действуют на центральную нервную систему, вызывая в ней тяжелые органические изменения, поражает также почки, органы кровообращения, легкие.
Марганец получил известность главным образом как профессиональный яд. При действии на организм через органы дыхания соединения марганца приводят к тяжелым поражениям центральной нервной системы, а также действуют на почки, органы кровообращения и легкие. Предельно допустимой концентрацией марганца и его соединений в воздухе является 0,0003 мг/л в пересчете на марганец (Н. В. Лазарев).
Острые отравления соединениями марганца нередко приводят к смерти. Причиной смерти были отравления и калия перманганатом, примененным при криминальном аборте.
Смертельная доза калия перманганата для человека точно неустановленна.
По данным А. О. Войнара, при приеме внутрь она составляет 15—20 г.
При вскрытии трупов лиц, погибших в результате отравления калия перманганатом, характерными считаются ожог слизистой оболочки, напоминающий отравление едкими веществами, дегенеративные изменения паренхиматозных органов, главным образом сердца, печени, почек (О. И. Глазова).
При полосканиях, спринцеваниях концентрированными растворами калия перманганата наблюдается отек слизистых оболочек с последующими воспалительными явлениями, приводящими иногда к общему отравлению организма. Независимо oт способа введения марганец выводится из организма через желудочно-кишечный тракт и с мочой. Основным органом, задерживающим марганец, является печень.
Марганец относится к числу широко распространенных элементов, играющих в организме животных определенную биологическую роль. Этим обстоятельством объясняется обязательное обнаружение марганца при судебно-химическом анализе внутренних органов трупа человека. Этим же диктуется необходимость количественного определения при положительных результатах качественного обнаружения его в биологическом материале.
Общее содержание Mn+2 в организме человека доходит до 0,05%; и в экскриментах его содержится 1,8 мг и в печени 0,17- 0,2 мг на 100 г свежего материала.
А.Н. Крылова дробным методом определяла в 100 г печени 0,13 – 0,40 мг естественно содержащегося Mn2+ , в почке и матке 0,06 – 0,28 и 0,04 - 0,16мг.
Обнаружение марганца
Обнаружение марганца основано на реакциях окисления Mn2+ до Mn7+ (перманганат–иона), который окрашивает реакционный раствор в цвета от розового до красно–фиолетового в зависимости от концентрации в минерали-зате.
1. Окисление калия перйоодатом
2 MnSO4 + 5 KIO4 + 3 H2O ® 2 HMnO4 + 5 KIO3 + 2 H2SO4
В присутствии марганца появляется окраска от розового до красно -фиолетового цвета.
2. Окислениеи натрия висмутатом
2 Mn(NO3)2 + 5 NaBiO3 + 16 HNO3 ®
® 2 HMnO4 + 5 Bi(NO3)3 + 5 NaNO3 + 7 H2O
В присутствии марганца появляется розовое окрашивание.
3. Окисление аммония персульфатом
2 MnSO4 + 5 (NH4)S2O8 + 8 H2O ® 2 HMnO4 + 5 (NH4)2SO4 + 7 H2SO4
В присутствии марганца появляется розовое окрашивание.
ХРОМ
Токсикологическое значение хрома. Соли хрома широко применяются в различных областях народного хозяйства. Некоторые соединения хрома используются в сельском хозяйстве. В медицине соединения хрома из-за их высокой токсичности в настоящее время не используются.
Наиболее ядовиты хроматы и бихроматы, последние токсичнее хроматов. Соли шестивалентного хрома обладают способностью, действовать раздражающе и прижигающе на кожу и слизистые оболочки, вызывая изъязвления. Типичным признаком является прободение хрящевой части носовой перегородки. В последнее время установлено, что хром обладает канцерогенным действием.
При приемах внутрь наблюдаются ожоги слизистой оболочки рта, пищевода, желудка, припухание, отечность, окрашивание в желтый цвет слизистой полости рта, рвота, иногда кровавая, желтыми или зелеными массами. В литературе имеются разноречивые данные о смертельной дозе солей кислоты хромовой: 0,2 - 0,5 -1 г и даже 8 г (Гадамер). При вскрытии трупов отмечаются явления отравления едкими веществами и желтое окрашивание слизистых оболочек. При острых отравлениях хром накапливается в печени, почках, эндокринных железах.
Хром относится к числу элементов, постоянно обнаруживаемых в организме животных и человека. Описанной выше методикой хром, естественно содержащийся в органах трупа человека, при химико-токсикологическом анализе не обнаруживается.
Обнаружение хрома
При обнаружении хрома, который при минерализации объекта смесью серной и азотной кислот находится в минерализате в основном в степени окисления 3+, его окисляют аммония персульфатом до степени окисления 6+.
В качестве основной реакции используется реакция взаимодействия Cr6+ с дифенилкарбазидом.
1. Реакция с дифенилкарбазидом
Cr2(SO4)3 + 3 (NH4)2S2O8 + 7 H2O 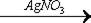 ® H2Cr2O7 + 3 (NH4)2SO4 + 6 H2SO4
® H2Cr2O7 + 3 (NH4)2SO4 + 6 H2SO4
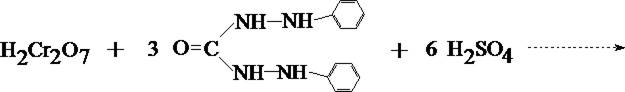
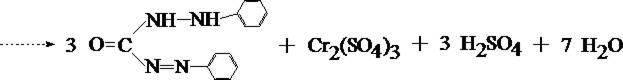
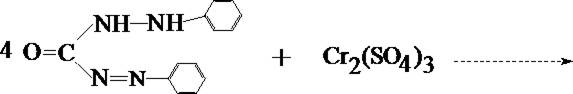
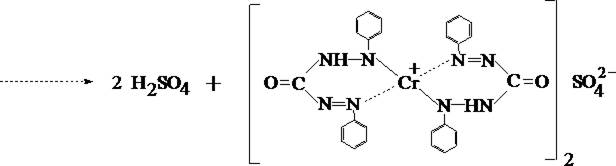
При наличии хрома жидкость в пробирке приобретает красно–фиолетовое окрашивание.
2. Реакция образования надхромовых кислот
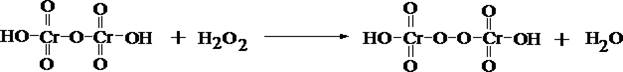

В присутствии хрома растворитель окрашивается в сине–голубой цвет.
Дата добавления: 2015-08-01; просмотров: 2112;
