Задача легко решается для идеально-газовой смеси, поскольку для нее
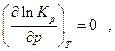
и так как 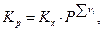 то
то
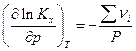
и, следовательно, состав равновесной системы зависит от знака Σ νi , т.е. от знака изменения числа молей газообразных участников реакции. Однако, как мы увидим ниже, случай, когда Σ νi = 0, требует дополнительного изучения.
15.8. Расчет константы равновесия по таблицам термодинамических величин.
Из вышеизложенного очевидно, что для определения направления химического процесса в системе данного состава необходимо знать величину константы равновесия при данной температуре.
Тепловой эффект химической реакции 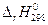 и ее энтропия (
и ее энтропия ( 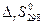 ) при 298,15 К легко рассчитываются с помощью энтальпий образования (
) при 298,15 К легко рассчитываются с помощью энтальпий образования ( 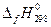 ) и абсолютных энтропий (
) и абсолютных энтропий ( 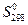 ) участников химической реакции по закону Гесса :
) участников химической реакции по закону Гесса :
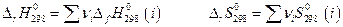
При температурах, отличающихся от условной (298 К)
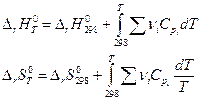
таким образом необходимо знать зависимость теплоемкостей участников химического процесса от температуры и тогда при температуре T > 298 K
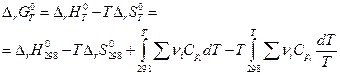
и 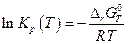
Практически стоит иметь в виду, что два интеграла в правой части приблизительно равны по величине и противоположны по знаку, поэтому для оценочных расчетов можно записать
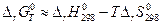
Точный расчет можно выполнить следующим образом (метод Темкина – Шварцмана, 1948). При температурах выше 298 К зависимость теплоемкости вещества от температуры аппроксимируется полиномом :
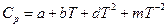
следовательно 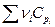 тоже полином:
тоже полином:
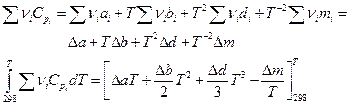
Далее по уравнению Гиббса-Гельмгольца
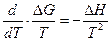
Разделим переменные и возьмем интегралы от 298 до Т
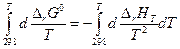
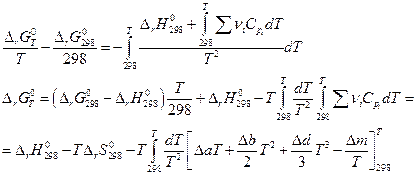
Так как Δ а, Δ b, Δ d и Δ m от температуры не зависят, то интегралы берутся без труда и
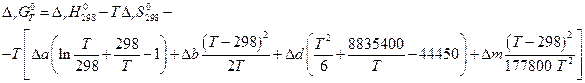
Выражения, стоящие при Δ а, Δ b, Δ d и Δ m являются функциями только температуры, обозначаются М0 , М1 , М2 и М-2 могут быть заранее вычислены и табулированы, что сделали Темкин и Шварцман. Значения этих коэффициентов приводятся в справочниках физико-химических величин. Таким образом :
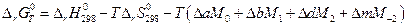
Пример. Рассчитать константу равновесия и степень диссоциации водяного пара при 2000 К.
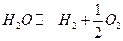
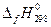
| -241840 | Дж/моль | ||
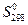
| 188,74 | 130,6 | 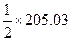
| 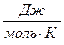
|
| а | 30,00 | 27,28 | 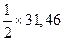
| |
| в | 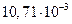
| 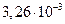
| 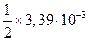
| |
| т | 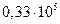
| 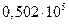
| 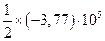
|
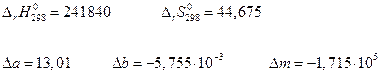
При 2000 К 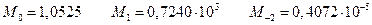
Тогда
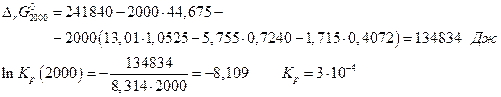
Степень диссоциации рассчитаем следующим образом. Если был взят 1 моль водяного пара, то после диссоциации α молей Н2О образовалось при равновесии α молей Н2 и 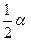 молей О2 . Общее число молей газовой смеси станет
молей О2 . Общее число молей газовой смеси станет
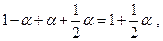 тогда мольные доли реагентов равны :
тогда мольные доли реагентов равны :
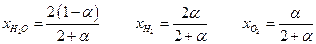
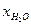
Если общее давление Р , то парциальные давления :
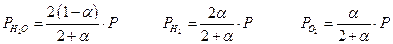
и следовательно
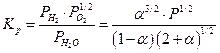
Таким образом, имея величину Кр и задав давление Р, можно вычислить α. Выражение можно упростить, если 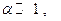 тогда
тогда
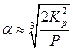
и 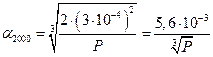
Если Р = 1 атм , то 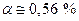
15.9. Расчет константы равновесия в неидеальных газовых системах.
В газообразной системе, где давление достаточно велико, условие равновесия приводит к выводу, что
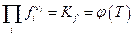
где fi - летучесть i –ого компонента. Поскольку 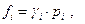 где γi - коэфициент летучести, то очевидно, что
где γi - коэфициент летучести, то очевидно, что
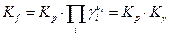
Поскольку при р = 1 атм, коэфициенты летучести равны единице, то численное значение Kf очевидно равно величине Kp при р = 1.
Для расчета величин γ удобно воспользоваться законом соответственных состояний.
Пример. Реакция 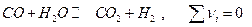 и давление как будто не должно влиять на состав равновесной системы. Рассмотрим эту систему при 900К и500 атм
и давление как будто не должно влиять на состав равновесной системы. Рассмотрим эту систему при 900К и500 атм
| Ркр | Ткр | τ | π | γ | |
| СО | 34,6 | 6,72 | 14,45 | 1,2 | |
| Н2О | 218,5 | 1,39 | 2,29 | 0,7 | |
| Н2 | 12,8 | 21,9 | 24,05 | 1,1 | |
| СО2 | 2,96 | 6,84 | 1,1 |
Отсюда
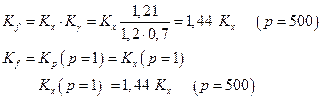
Следовательно, состав равновесной смеси сдвигается в сторону исходных веществ при увеличении давления.
Пример. Равновесие синтеза аммиака.
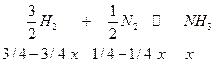
| 1 моль исходной стехиометрической смеси, а при равновесии получаем х молей аммиака. |
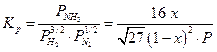
Температура 723 К
| Ратм | хэксп | 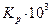
| 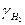
| 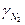
| 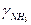
| 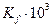
|
| 0,0021 | 6,50 | 6,50 | ||||
| 0,0204 | 6,59 | 1,003 | 1,005 | 0,997 | 6,53 | |
| 0,0380 | 6,76 | 1,01 | 1,014 | 0,991 | 6,55 | |
| 0,0917 | 6,90 | 1,015 | 1,024 | 0,985 | 6,57 | |
| 0,1636 | 7,25 | 1,03 | 1,047 | 0,970 | 6,57 | |
| 0,355 | 8,84 | 1,09 | 1,14 | 0,910 | 6,62 | |
| 0,536 | 12,94 | 1,18 | 1,33 | 0,83 | 7,27 | |
| 0,694 | 23,28 | 1,36 | 1,61 | 0,89 | 10,39 |
Примечание : коэфициенты летучести найдены исходя из закона соответственных состояний, как 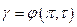 .
.
Например, при 300 атм Кγ = 0,795
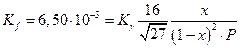
Подставив величины 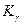 и Р , получаем расчетное
и Р , получаем расчетное 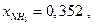 что очень близко к экспериментальной величине 0,355.Из таблицы видно также, что при давлениях выше 300 атм постоянства Kf не наблюдается, но это, очевидно, связано со способом оценки величин γ по закону соответственных состояний.
что очень близко к экспериментальной величине 0,355.Из таблицы видно также, что при давлениях выше 300 атм постоянства Kf не наблюдается, но это, очевидно, связано со способом оценки величин γ по закону соответственных состояний.
I. Глава 16. Тепловая теорема Нернста
16.1. Постановка проблемы.
Дата добавления: 2015-07-30; просмотров: 1060;
