Глава 18. Неравновесные явления в растворах электролитов.
18.1. Общая характеристика неравновесных явлений в растворах электролитов.
Рассмотренные ранее (в гл.12) ион-дипольное и ион-ионное взаимодействия относятся к равновесному состоянию раствора, когда оно не изменяется во времени и раствор не подвергается внешнему воздействию. Однако равновесие в растворах электролитов всегда является динамическим, усредненным по времени и по объему. Неравновесные явления в растворах электролитов можно вызвать следующими способами:
1. изменением концентрации (активности) растворенного вещества в одной части раствора по отношению к другой без изменения химического состава раствора;
2. наложением электрического поля, которое вызовет направленное перемещение заряженных частиц;
3. изменением состава раствора по отношению к равновесной концентрации возможных для данной системы веществ.
В первом случае количество перескоков частицы i в единицу времени в направлении уменьшения ее концентрации оказывается больше, чем в обратном направлении, в результате чего возникает диффузионный поток частиц i . Очевидно подобный поток возникает при электролизе.
Во втором случае положение электрического поля изменяет вероятность перескоков заряженных частиц по полю и против поля, в результате чего возникают потоки миграции катионов и анионов, что составляет основу электропроводности электролитов.
В третьем случае изменение состава раствора нарушает ионное равновесие и вызывает химическую реакцию, в ходе которой происходит восстановление ионного равновесия. Ионные реакции в растворах электролитов представляют собой частный случай гомогенных химических реакций и изучаются химической кинетикой. Отличительная особенность – высокая скорость таких реакций и во многих случаях нулевая энергия активации (например, реакция нейтрализации).
18.2. Диффузия и миграция ионов.
Поток диффузии jd , т.е. количество частиц, диффундирующих через единичную площадь в единицу времени, пропорционален концентрации этих частиц Ci и градиенту химического потенциала
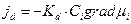
где Kd – константа пропорциональности. Так как 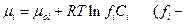 коэффициент активности) и для одномерного случая
коэффициент активности) и для одномерного случая
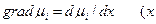 - координата), то легко получить закон Фика :
- координата), то легко получить закон Фика :
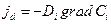
где коэффициент диффузии Di равен
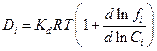
Поток миграции jm пропорционален концентрации ионов Ci и градиенту электрического потенциала
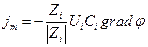
Константой пропорциональности здесь является величина Ui , называемая электрической подвижностью иона, которая определяет среднюю скорость движения иона при единичном градиенте электрического потенциала (или напряженности поля в В/м или В/см).
В общем случае ион движется под действием обоих градиентов и суммарный поток
j = jd + jm
а общей движущей силой является градиент электрохимического потенциала (см. ниже) ηi :
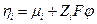
где F – число Фарадея, численно равное заряду 1 моля электронов
(F = 96487 Кл/моль).
Если 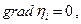 то j = 0 т.е. ионы не перемещаются в растворе, т.е. jd + jm = 0 и gradμi = -ZiFgradφ
то j = 0 т.е. ионы не перемещаются в растворе, т.е. jd + jm = 0 и gradμi = -ZiFgradφ
Отсюда
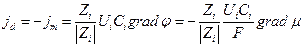
Следовательно 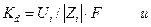
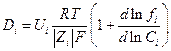
При 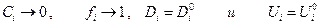
Итак
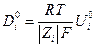
Дата добавления: 2015-07-30; просмотров: 1545;
