I8 ГЛАВА 1
С развитием технологии рекомбинантных ДН К природа биотехнологии изменилась окончательно и бесповоротно. Появилась возможность оптимизировать этап биотрансформации более прямым путем, создавать, а не просто отбирать высокопродуктивные штаммы, использовать микроорганизмы и эукариотические клетки как «биологические фабрики" для производства инсулина, интерферона, гормона роста, вирусных антигенов и множества других белков. Технология рекомбинантных ДНК позволяет получать в больших ко-личествах ценные низкомолекулярные вещества и макромолекулы, которые в естественных условиях синтезируются в минимальных количествах. Растения и животные стали естественными биореакторами, продуцирующими новые или изме-
ненные генные продукты, которые никогда не могли бы быть созданы методами мутагенеза и селекции или скрещивания. Наконец, эта новая технология способствует развитию принципиально новых методов диагностики и лечения различных заболеваний.
На стыке технологии рекомбинантных ДНК и биотехнологии возникла новая область исследований, динамичная и высококонкурентоспособная, - молекулярная биотехнология. Эта молодая дисциплина, как и молекулярная биология в период своего становления, весьма амбициозна, заявляемые ею притязания не всегда соответствуют реальным возможностям. Ее стратегия и экспериментальная база претерпевают быстрое изменение, одни подходы все время вытесня-
| Таблица 1.1. История развития молекулярной биотехнологии | |
| Дата | Событие |
| Карл Эреки ввел термин «биотехнология" | |
| Произведен пенициллин в промышленном масштабе | |
| Эвери. МакЛеод и МакКарти показали, что генетический материал представляет собой ДНК | |
| Уотсон и Крик определили структуру молекулы ДНК | |
| Учрежден журнал "Biotechnology and Bioengineering" | |
| 1961-1966 | Расшифрован генетический код |
| Выделена первая рестрицирующая эндонуклеаза | |
| Корана и др. синтезировали полноразмерный ген тРНК | |
| Бойери Коэн положили начало технологии рекомбинантных ДНК | |
| Колер и Мильштейн описали получение моноклональных антител | |
| Изданы первые руководства, регламента руюшие работы с рекомбинантными ДНК | |
| Разработаны методы определения нуклеотндной последовательности ДНК | |
| Фирма Genentech выпустила человеческий инсулин, полученный с помощью E. coli | |
| Верховный суд США, слушая дело Даймонд против Чакрабарти, вынес вердикт, что микроорганизмы, полученные генноинженерными методами, могут быть запатентованы | |
| Поступили в продажу первые автоматические синтезаторы ДНК | |
| Разрешен к применению в США первый диагностический набор моноклональных антител | |
| Разрешена к применению в Европе первая вакцина для животных, полученная по технологии рекомбинантных ДНК | |
| Для трансформации растении применены гибридные Ti-плазмиды | |
| Выдан патент США на линию мышей с повышенной частотой возникновения опухолей, полученную генноинженерными методами | |
| Создан метод полимеразной цепной реакции (ПЦР) | |
| В США утвержден план испытаний генной терапии с использованием соматических клеток человека | |
| Официально начаты работы над проектом «Геном человека» | |
| 1994-1995 | Опубликоованы подробные генетические и физические карты хромосом человека |
| Ежегодный объем продаж первого рекомбинантного белка (эритропоэтина) превысил 1 млрд. долларов | |
| Определена нуклеотидная последовательность всех хромосом эукаристического микроорганизма (Saccharomyces cerevisiae) | |
| Клонировано млекопитающее из дифференцированной соматической клетки |
Mолекулярно-биотехнологическая революция 19
|
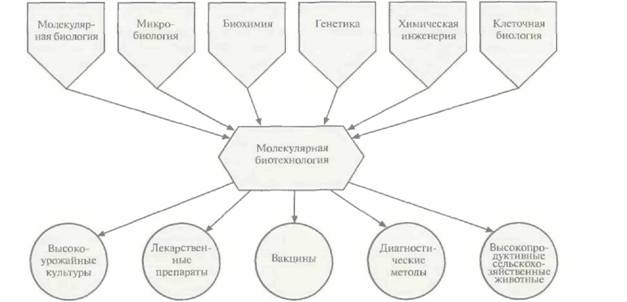
| Рис. 1.2. Молекулярная биотехнология использует достижения многих областей науки и позволяет создавать широкий ассортимент коммерческих продуктов и методов. |
ются другими. Но несомненно одно: в будущем молекулярная биотехнология станет рутинным методом создания живых систем, обладающих новыми функциями и возможностями.
Очень редко новые научные дисциплины возникают «на пустом месте»; как правило, их фундаментом служат различные области науки. Что касается молекулярной биотехнологии, то ее биотехнологическая составляющая относится к сфере промышленной микробиологии и химической инженерии, а молекулярная — к областям молекулярной биологии, молекулярной генетики бактерий и энзимологии нуклеиновых кислот (табл. 1.1). В широком смысле молекулярная биотехнология пользуется достижениями самых разных областей науки и применяет их для создания самых разных коммерческих продуктов (рис. 1.2).
Коммерциализация молекулярной биотехнологии
Конечной целью всех биотехнологических исследований является создание коммерческого продукта. Следовательно, молекулярная биотехнология тесно связана с экономикой. Конечно, сейчас ее развитие обусловливается не только экономическими факторами, однако на первых порах ажиотаж вокруг этой молодой науки был связан с возможностью получения прибыли. К вечеру 15 октября 1980 г. основные держатели акций фирмы Genentech стали обладателями миллионных состояний, и это побудило очень многих людей к энергичным действиям. В период 1980—1983 гг. в Соединенных Штатах было создано около 200 мелких биотехнологических компаний; этому способствовали введение налоговых льгот, высокие прибыли от операций с ценными бумагами и заинтересованность частных вкладчиков. Вслед за Гербертом Бойером, который вначале был научным сотрудником Калифорнийского университета в Сан-Франциско, а затем стал вице-президентом фирмы Genentech, многие университетские профессора открыли собственные компании.
К 1985 г. в Соединенных Штатах было уже более 400 биотехнологических фирм; многие из них включили в свое название слово «ген», чтобы заявить о принадлежности к генноинженерному «цеху»: Biogen, Amgen, Calgene, Engenics, Genex, Cangene. На сегодняшний день в США свыше 1500 биотехнологических компаний, а во
20 ГЛАВА 1
всем мире их более 3000. Кроме того, большой вклад в развитие молекулярной биотехнологии внесли все крупные международные химические и фармацевтические компании, в том числе Monsanto, Du Pont, Upjohn, American Cyanamid, Eli Lilly, SmithKline Beecham, Merck, Novartis, Hoffman-LaRoche. В период бурного развития биотехнологического бизнеса в 80-е годы мелкие компании поглощались крупными, образовывались совместные предприятия. Например, в 1991 г. 60% акций компании Genentech было продано фирме Hoffmann-LaRoche за 2,1 млрд. долларов. В то же время многие компании обанкротились. Такая мобильность — характерная особенность биотехнологической индустрии.
К середине 90-х годов на рынке появилось более десятка новых биотехнологических лекарственных препаратов, более 100 препаратов сейчас проходят клинические испытания, еще свыше 500 находятся на стадии разработки. Создано и выпущено на рынок множество новых молеку-лярно-биотехнологических продуктов, повышающих урожайность сельскохозяйственных культур и продуктивность сельскохозяйственных животных. Ежегодный доход молекулярно-био-технологической индустрии увеличился с 6 млн. долларов в 1986 г. до примерно 30 млрд. в 1996 г. По оценкам, к 2000 г. объем продаж продуктов, изготовленных с применением молекулярной биотехнологии, превысит 60 млрд. долларов в год. И хотя в целом доходность биотехнологического бизнеса оказалась не такой высокой, как ожидалось, энтузиазм инвесторов не ослабевает и свидетельствует о том, что молекулярная биотехнология — по крайней мере по их представлениям — имеет блестящие перспективы.
Все новые независимые молекулярно-био-технологические компании узкоспециализированы, что часто находит отражение в их названии. Например, вслед за компаниями, занимающимися клонированием генов, в США появились компании, выпускающие полученные генноинженерными методами антитела, которые предназначены для лечения инфекционных заболеваний, рака и других болезней человека: Immunex, ImmuLogic, ImmunoGen, Immunomedics, Medlmmune, Immune Response.
Большая часть коммерческих разработок в области молекулярной биотехнологии приходится на Соединенные Штаты. В других странах, где инвестиционный климат не столь благоприятен и бизнес менее активен, главную роль в создании молекулярно-биотехнологических предприятий играют крупные корпорации и государство. Так, правительство Японии объявило биотехнологию «стратегической индустрией» и национальным приоритетом. За дело взялись крупные японские корпорации. Вначале им не хватало собственных кадров, и первые исследования проводились в сотрудничестве с американскими университетами и компаниями. Сейчас эти корпорации приобрели необходимый опыт и сами проводят молекулярно-био-технологические разработки и создают генноинженерные продукты.
Европейская биотехнологическая индустрия тоже неуклонно развивается: к 1995 г. в странах Европы было создано более 600 биотехнологических компаний. В экономически менее развитых странах роль «локомотива» в развитии национальной молекулярно-биотехнологической индустрии взяло на себя государство. Стимулом здесь служила уверенность в том, что молекулярная биотехнология — «самая революционная из всех технологий XX века». Ни одна страна не хотела оказаться лишенной всех тех благ, которые сулило ее развитие.
Сейчас, в конце второго десятилетия своего развития, молекулярная биотехнология фактически стала одной из отраслей промышленности, хотя вначале некоторые ученые считали ее чисто эзотерическим направлением. Без сомнения, в ближайшие десять лет коммерческую молекулярную биотехнологию ожидает бурный рост, но именно поэтому давать какие-то конкретные прогнозы здесь весьма рискованно,
Надежды и опасения
С молекулярной биотехнологией человечество связывают самые большие надежды:
• возможность точной диагностики, профилактики и лечения множества инфекционных и генетических заболеваний
• значительное повышение урожайности сельскохозяйственных культур путем создания
Молекулярно-биотехнологическая революция 21

| |
| Создание функциональных бактериальных плазмид in vitro S.N. Cohen, A.C.Y. Chang, H.W. Boyer, R.B. Helling Рroc. Natl. Acad. Sci. USA 70: 3240-3244, 1973 | |
| Отсчет истории технологии рекомбинантных ДНК ведется с работы Коэна и др., которые показали, как, объединив генетические элементы из разных источников, можно создать новую реплицирующуюся генетическую структуру. Эту структуру Коэн и др. получили из автономно существующих в бактериальной клетке внехромосомных генетических элементов, называемых плазмидам и. В своей предыдущей работе (Cohen, Chang. Proc. Natl. Acad Sci. USA 70: 1293-1297, 1973) авторы получили маленькую плазмиду из более крупной природной, отрезал от последней случайные фрагменты и вводя их смесь в клетки E. coli. Один из та-ких фрагментов размером около 1/10 размера исходной плазмиды «прижился» в бактериальной клетке как функционирующая плазми-да Чтобы исключить фактор случайности, присущий подобному подходу, и сделать процесс манипулирования генетическим материалом более управляемым, Коэн и др. решили использовать фермент (рестрицирующую эндонуклеазу), который расщепляет молекулу ДНК в строго определенном месте с образованием фрагментов с выступающими концами (липкими концами). Фрагменты разных молекул ДНК, обработанных одним и тем же ферментом, имели одинаковые липкие концы и при отжиге соединялись. Таким образом, если расщепить ДНК из равных источников одной и той же рестрицирующей эндонуклеа-зой, а затем смешать фрагменты, то образуются новые комбинированные молекулы ДНК, не существовавшие прежде. Коэн и др. не только смогли перенести ген из одной плазмиды в другую, но и показали, что этот ген остается биологически активным. К их чести, они в полной мере осознали, что данная стратегия «позволяет внедрять специфические нуклеотидные последовательности прокариотической или эукариотической хромосомы или внехромосомной ДНК в независимо реплицирующуюся бактериальную плазмиду. Другими словами, любой ген, взятый из любого организма, теоретически можно встроить в плазмиду, которая будет размножаться в клетке-хозяине, и при этом, возможно, будет синтезироваться белок, кодируемый клонированным геном. Проиллюстрировав возможность клонирования генов, Коэн и др. создали экспериментальную базу для технологии рекомбинантных ДНК, показали, что плазмиды могут служить носителями и векторами клонированных генов. Последующие работы очень скоро привели к созданию более сложных векторов и стратегий клонирования. Все это вызвало серьезную озабоченность относительно безопасности и этичности подобных экспериментов, и чтобы снять обеспокоенность общественности, были разработаны официальные инструкции и соз-даны правительственные органы, регламентирующие работы с рекомбинантными ДНК. Завершал перечень тех последствий, к которым привела публикация работы Козна и др., отметим, что она самым непосредственным образом повлияла на становление молекулярно-биотехнологической индустрии. |
растений, устойчивых к вредителям, грибковым и вирусным инфекциям и вредным воздействиям окружающей среды
• создание микроорганизмов, продуцирующих различные химические соединения, антибиотики, полимеры, аминокислоты, ферменты
• создание пород сельскохозяйственных и других животных с улучшенными наследуемыми признаками
• переработка отходов, загрязняющих окружающую среду.
Обсуждать все блага, которые нас ожидают, легко и приятно, но одновременно нельзя забывать о последствиях, к которым может привести столь бурное развитие молекулярной биотехнологии. Эта новая отрасль раскинула свои сети так широко, что общество вправе получить ответы на свои вопросы:
• не будут ли организмы, полученные методами генной инженерии, оказывать вредное воздействие на другие живые организмы или на окружающую среду?
• не приведет ли создание и распространение генетически модифицированных организмов к уменьшению природного генетического разнообразия?
• правомочно ли, используя генноинженерные методы, изменять генетическую природу человека?
Дата добавления: 2015-07-14; просмотров: 3158;
