Глава 15. Термодинамика системы с химической реакцией.
15.1. Химическая переменная. Условия химического равновесия.
Если система закрытая, то ее состав может изменяться только в связи с наличием химической реакции 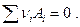 Очевидно, что изменение чисел молей участников химической реакции пропорционально стехиометрическим коэффициентам, поэтому можно записать
Очевидно, что изменение чисел молей участников химической реакции пропорционально стехиометрическим коэффициентам, поэтому можно записать 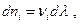 где
где 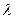 - химическая переменная – величина, показывающая сколько раз в системе осуществлялась химическая реакция. Эта величина равна нулю в начальный момент реакции и единице, когда в реакцию вступили числа молей веществ, равные стехиометрическим коэффициентам. Как и ранее, стехиометрические коэффициенты исходных веществ берем со знаком «минус», продуктов реакции со знаком «плюс». Тогда изменение энергии Гиббса системы при протекании в ней химической реакции можно представить
- химическая переменная – величина, показывающая сколько раз в системе осуществлялась химическая реакция. Эта величина равна нулю в начальный момент реакции и единице, когда в реакцию вступили числа молей веществ, равные стехиометрическим коэффициентам. Как и ранее, стехиометрические коэффициенты исходных веществ берем со знаком «минус», продуктов реакции со знаком «плюс». Тогда изменение энергии Гиббса системы при протекании в ней химической реакции можно представить
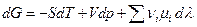
Заметим, что аналогичные выражения можно записать и для других характеристических функций системы, сделав только подходящий выбор независимых переменных.
Таким образом в связи с наличием химической реакции энергия Гиббса системы оказывается функцией трех переменных Т, р и λ, следовательно:
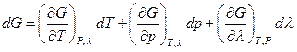
Сравнив оба выражения для dG , имеем
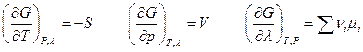
Последнее равенство и определяет направление химической реакции изобарно-изотермической системы : при Т,р = const реакция протекает самопроизвольно, если
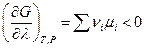
а химическое равновесие наступает при условии, что
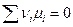
|
Это самое общее условие химического равновесия.
15.2. Химическое равновесие в смесях идеальных газов. Константа равновесия.
В смеси идеальных газов химический потенциал i - ого компонента
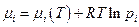 и если налицо химическое равновесие, то
и если налицо химическое равновесие, то
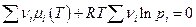
Это выражение легко преобразуется к виду :
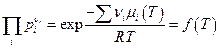
(Π –пи заглавное – символ произведения, как знак Σ – символ суммы). Мы видим, что произведение парциальных давлений компонентов в идеальной газовой смеси, где происходит химическая реакция, которая пришла к равновесию, является функцией только температуры. Это произведение обозначается как Кр и называется константой равновесия :
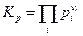
Но химический потенциал i – ого компонента можно выразить через мольную долю его в смеси 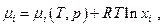 применив условие химического равновесия, получим
применив условие химического равновесия, получим
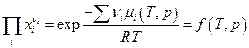
и аналогично 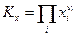
иными словами, вообще говоря константа равновесия по мольным долям Кх должна быть функцией температуры Т и общего давления в системе Р. Связь между Кр и Кх легко обнаруживается, если учесть, что рi = xiP , отсюда
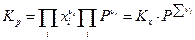
Очевидно, что Кх зависит от давления, если 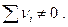
Так как 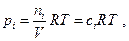 где ci - объемная концентрация i – ого компонента, то
где ci - объемная концентрация i – ого компонента, то
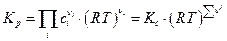
Следует всегда помнить, что для продуктов реакции стехиометрические коэфициенты берутся со знаком “+”, для исходных веществ со знаком “-“.
Пример.
Равновесная система 2SO2 + O2 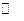 2SO3 , 1000 K
2SO3 , 1000 K
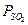
| 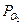
| 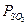
| 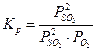
| 
|
| атм | ||||
| 0,273 | 0,402 | 0,325 | 3,53 | 1,000 |
| 0,309 | 0,358 | 0,338 | 3,34 | 1,005 |
| 0,456 | 0,180 | 0,364 | 3,54 | 1,000 |
| 0,470 | 0,167 | 0,365 | 3,61 | 1,002 |
| 0,481 | 0,164 | 0,355 | 3,32 | 1,000 |
| 0,564 | 0,102 | 0,334 | 3,44 | 0,997 |
| 0,566 | 0,101 | 0,333 | 3,42 | 1,000 |
| Среднее | 3,46 |
15.3. Энергия Гиббса химической реакции
Если химическая реакция 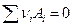 в системе реально протекает, то изменяется энергия Гиббса системы :
в системе реально протекает, то изменяется энергия Гиббса системы :
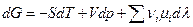
Пусть р,Т = const, тогда 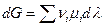 и проинтегрируем для одного пробега химической реакции ( т.е. λ меняется от 0 до 1 )
и проинтегрируем для одного пробега химической реакции ( т.е. λ меняется от 0 до 1 )
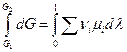
Слева интеграл берется без труда, а справа положим, что все μi = const. Это равносильно предположению, что система содержит достаточно большое количество реагентов Ai , чтобы убыль числа молей исходных веществ, равных их стехиометрическим коэфициентам практически не меняет состав системы, а следовательно и химические потенциалы μi = const. Тогда
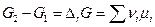
Величина 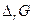 называется энергией Гиббса химической реакции и представляет собой изменение энергии Гиббса бесконечно большой системы, когда в реакцию вступили числа молей исходных веществ, равные стехиометрическим коэффициентам, и появились числа молей продуктов реакции, равные стехиометрическим коэффициентам ( Δλ = 1 ).
называется энергией Гиббса химической реакции и представляет собой изменение энергии Гиббса бесконечно большой системы, когда в реакцию вступили числа молей исходных веществ, равные стехиометрическим коэффициентам, и появились числа молей продуктов реакции, равные стехиометрическим коэффициентам ( Δλ = 1 ).
Обозначим р*i парциальное давление i –ого компонента в системе, когда химическая реакция реально протекает, тогда 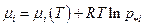 и
и
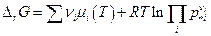
Но 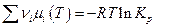 (см. выше), следовательно:
(см. выше), следовательно:
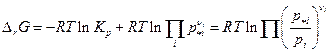
Во-первых, мы видим, что величины p* i и pi должны иметь одинаковую размерность (обычно атм), во-вторых, направление химического процесса зависит от знака ΔrG, который в свою очередь зависит от знака логарифма. Если ΔrG <0 реакция самопроизвольно идет слева направо, при ΔrG >0 идет самопроизвольно справа налево. Если же ΔrG = 0, то система равновесна и
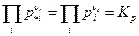
Если в химическую реакцию вступают компоненты с парциальным давлением, равным единице (1 атм), т.е. вещества вступают в реакцию в стандартном состоянии, то тогда
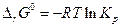
Величина 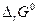 называется стандартной энергией Гиббса химической реакции и, очевидно к равновесию не имеет никакого отношения, поскольку определяет направление химической реакции, когда каждое pi = 1.
называется стандартной энергией Гиббса химической реакции и, очевидно к равновесию не имеет никакого отношения, поскольку определяет направление химической реакции, когда каждое pi = 1.
Если реакция протекает при постоянных V и T , то тогда
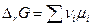 и соответственно
и соответственно
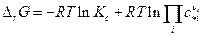
а при 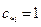
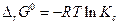
15.4. Химическое равновесие в реальных системах.
Химические реакции могут протекать в растворах, а также между раствором и газовой фазой, которые вообще говоря могут быть и неидеальные. Но условие химического равновесия было выведено для любых систем, поэтому константу химического равновесия в самом общем виде можно записать как :
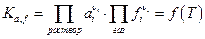
Вид функции f (T), очевидно, будет зависеть от выбора стандартного состояния для летучестей и особенно для активностей участников реакции. Заметим, что для идеально-газовой смеси
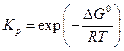
15.5. Гетерогенные химические равновесия.
Гетерогенными химическими равновесиями называют равновесия, если они устанавливаются между веществами, находящимися в разных фазах. Наиболее простой и весьма часто встречающийся случай – это равновесие между газовой фазой и твердыми фазами, имеющими постоянный состав. Например :
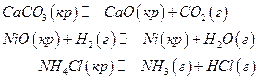
Следует иметь в виду, что химический потенциал конденсированной фазы постоянного состава (к.ф.п.к.) совпадает с мольной энергией Гиббса вещества и является при постоянном давлении функцией только температуры. Поэтому условие равновесия в этом случае запишется как
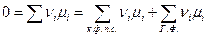 или
или
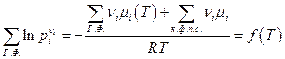
Таким образом в константу равновесия Кр входят только парциальные давления газообразных реагентов. Аналогично будет записана и энергия Гиббса химической реакции
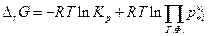
Следует отметить, что если химическая реакция протекает между фазами постоянного состава :
ВаО (кр) + ТiO2 (кр) = BaTiO3 (кр)
то реакция протекает до конца в сторону уменьшения энергии Гиббса системы, поскольку на зависимости G от λ нет экстремума.
15.6. Влияние температуры на константу равновесия.
Так как при 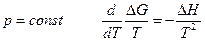 (уравнение Гиббса – Гельмгольца) , а
(уравнение Гиббса – Гельмгольца) , а 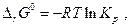 то, очевидно, что
то, очевидно, что
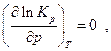
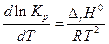
Таким образом, знак производной 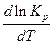 зависит от знака
зависит от знака 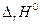 . Если
. Если 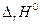 > 0 (эндотермическая реакция), то Кр растет с температурой, если
> 0 (эндотермическая реакция), то Кр растет с температурой, если 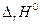 < 0 (экзотермическая реакция), константа равновесия уменьшается с ростом температуры.
< 0 (экзотермическая реакция), константа равновесия уменьшается с ростом температуры.
Полученное уравнение (изобара Вант-Гоффа) можно проинтегрировать,положив в первом приближении, что 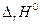 = const, тогда
= const, тогда
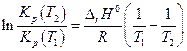
и если известны константы равновесия при двух разных температурах, то можно вычислить тепловой эффект реакции 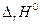 .
.
15.7. Влияние давления на состав равновесной системы.
Дата добавления: 2015-07-30; просмотров: 969;
