Если газ реальный и работа его изотермического изменения объема
Ареальн. измерена, то можно записать, что
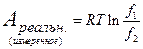
где f – некоторое свойство реального газа, которое определяет в таком простом соотношении его реальную измеряемую работу изотермического изменения объема. Назовем это свойство летучестью (иногда называют фугитивностью : английское fugacity – летучесть). Таким образом, для реального газа можно записать (Гилберт Ньютон Льюис, 1907) :
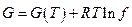
а для его химического потенциала в смеси
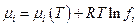
Задача упростилась, но не намного, поскольку необходимо указать способы определения летучести газа в конкретных условиях. Но прежде чем перейти к этой проблеме дадим один пример экспериментального определения величины работы изотермического изменения объема реального газа.
В таблице приведены результаты измерений электродвижущих сил Е гальванического элемента:
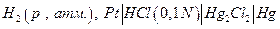
в зависимости от давления водорода при 25 0С и рассчитанные по этим экспериментальным данным величины летучести водорода при соответствующих давлениях следующим образом.
| р, атм | Е, мВ | Е(р) – Е(1) | 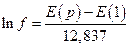
| f, атм |
| 1,00 | 399,0 | 1,0 | ||
| 37,8 | 445,6 | 46,6 | 3,630 | 37,7 |
| 51,6 | 449,6 | 50,6 | 3,942 | 51,5 |
| 110,2 | 459,6 | 60,6 | 4,721 | 112,3 |
| 204,7 | 468,3 | 69,6 | 5,422 | 226,3 |
| 386,6 | 478,4 | 79,4 | 6,185 | 485,5 |
| 439,3 | 480,4 | 81,4 | 6,341 | 567,4 |
| 556,8 | 484,4 | 85,4 | 6,653 | 774,8 |
| 568,8 | 485,0 | 86,0 | 6,699 | 811,9 |
| 701,8 | 489,1 | 90,1 | 7,019 | 1117,4 |
| 707,8 | 489,9 | 90,9 | 7,081 | 1189,3 |
| 731,8 | 489,3 | 90,3 | 7,034 | 1135,0 |
| 754,4 | 490,3 | 91,3 | 7,112 | 1226,9 |
| 862,2 | 493,2 | 94,2 | 7,338 | 1537,9 |
| 893,9 | 493,8 | 94,8 | 7,385 | 1611,6 |
| 974,5 | 496,3 | 97,3 | 7,580 | 1957,9 |
| 1035,2 | 497,5 | 98,5 | 7,673 | 2149,8 |
Как мы узнаем ниже, разность Е(р) – Е(1) умноженная на 2F ( F – число Фарадея, равное 96487 кулонов/г-экв ) как раз равна работе расширения водорода при 25 0С от давления р до 1 атм
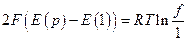
подстановка численных значений F, R и T дает
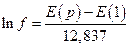
Таким образом летучесть, хотя и косвенно, в принципе можно измерить. Как видно из последней колонки таблицы, при давлениях выше 50 атм летучесть водорода начинает отличаться от давления и при 1000 атм превосходит давление примерно вдвое. Итак, летучесть это такое давление, которое должна оказывать идеально-газовая система, чтобы производить такое же действие, что и реальная система.
Понятно, что разность между летучестью и давлением стремится к нулю по мере приближения состояния реального газа к идеальному, т.е. при бесконечно малом давлении, тогда
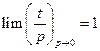
Для характеристики отклонения свойств реального газа от идеального вводится отношение летучести к давлению, которое называется коэфициентом летучести 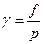
Заметим также - летучесть конденсированной фазы в гетерогенной системе равна летучести насыщенного пара, находящегося в равновесии с конденсированной фазой.
14.2. Методы расчета летучести.
Так как 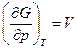 , а
, а 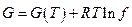 , то при T=const
, то при T=const
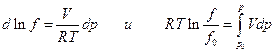
Если задано уравнение состояния реального газа , то интеграл можно вычислить аналитически. Пусть, например,
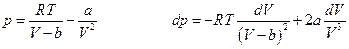 Тогда
Тогда
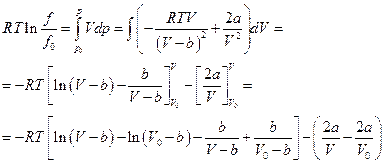
Устремим  тогда
тогда 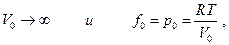 отсюда
отсюда
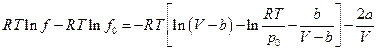 и
и
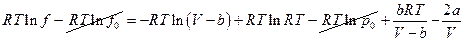
Окончательно: 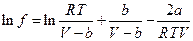
т.е. при данной температуре Т вычисляем V при данном давлении и подставляем в полученную формулу.
Можно поступить и следующим образом. Если при данной температуре Т измерены мольные объемы реального газа в зависимости от давления, то эту зависимость можно представить в виде
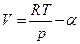
где α – экспериментальная объемная поправка, тогда очевидно, что
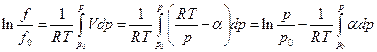
Если 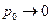 , то
, то 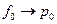 и
и
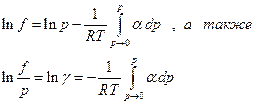
Интеграл можно вычислить графически. Приведем два примера :
| СО ,273 К | NH3 , 423 K | ||||||
| Р, атм | 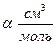
| f, атм | Р, атм | 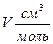
| 
| f | |
| 11,0 | 0,999 | - | |||||
| 12,5 | 24,62 | 760,7 | 106,8 | 35,5 | |||
| 10,6 | 46,60 | 226,7 | 120,5 | 73,0 | |||
| 8,5 | 72,13 | 66,40 | 165,9 | 89,5 | |||
| 6,3 | 95,38 | 46,88 | 126,7 | 98,0 | |||
| 2,0 | 141,7 | 40,24 | 75,47 | ||||
| -2,1 | 189,0 | 37,36 | 49,44 | ||||
| -9,0 | 298,0 | 34,22 | 23,65 | ||||
| -3,9 | 408,3 | 32,68 | 10,72 | ||||
| -7,4 | 547,6 | 31,41 | 3,31 | ||||
| -19,8 | 714,1 | ||||||
| -17,6 | 1152,0 | ||||||
| -24,3 | 1778,0 | ||||||
| -24,8 | 2183,0 | ||||||
| -25,3 | 2663,0 |
Стоит заметить, что при небольших давлениях 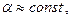 следовательно
следовательно
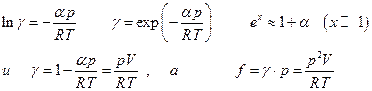
Полученные выражения для γ и f приближенные и годятся примерно до
50 - 100 атм.
14.3. Использование закона соответственных состояний.
Любое уравнение состояния реального газа должно учитывать тот факт, что при некоторой температуре газ должен конденсироваться и может находиться в равновесии с жидкой фазой. Анализ показывает, что при критической температуре должны соблюдаться два условия
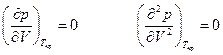
это приводит к тому, что правило фаз Гиббса для системы в критической точке однокомпонентной системы должно быть записано как
С = 1 – Ф
в связи с тем, что число степеней свободы уменьшается на 2. Следовательно в критической точке в системе находится одна фаза и число степеней свободы равно нулю, т.е.критическая точка однокомпонентной системы представляется фундаментальной точкой.
Уравнение состояния Ван-дер-Ваальса можно представить как кубическое относительно объема
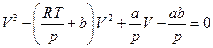
В критической точке при Ткр и ркр три корня уравнения равны, т.е.
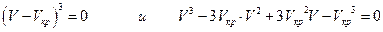 а так же
а так же
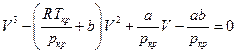
Сравнивая коэффициенты при одинаковых степенях V имеем :
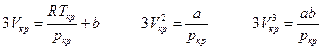
и для a , b и R в явном виде
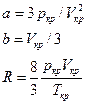
Подстановка констант в исходное уравнение Ван-дер-Ваальса дает
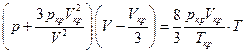
После умножения почленно на 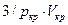 имеем
имеем
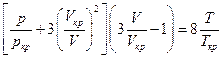
Ведем обозначения 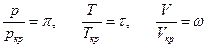 (
( 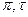 и ω носят название приведенных давления, температуры и объема), отсюда :
и ω носят название приведенных давления, температуры и объема), отсюда :
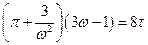
Заметим, что в полученное уравнение не входят какие-либо индивидуальные характеристики веществ, следовательно оно годится для любых веществ и носит название приведенного уравнения Ван-дер-Ваальса.
Очевидно, что при одинаковых 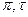 и ω свойства веществ должны быть одинаковы (закон соответственных состояний). Следовательно, можно предположить, что и коэффициенты летучести γ должны быть одинаковыми, поэтому зависимость γ = f (π, τ) должна иметь универсальный характер. Эта зависимость вычислена и в справочниках представляется как в виде таблиц, так и графиков. Для водорода, гелия и неона необходимо вводить поправку :
и ω свойства веществ должны быть одинаковы (закон соответственных состояний). Следовательно, можно предположить, что и коэффициенты летучести γ должны быть одинаковыми, поэтому зависимость γ = f (π, τ) должна иметь универсальный характер. Эта зависимость вычислена и в справочниках представляется как в виде таблиц, так и графиков. Для водорода, гелия и неона необходимо вводить поправку :
Ткр + 8, ркр + 8 атм.
Пример : аммиак, Ткр = 405,6 К; ркр = 111,5 атм при температуре 425 К, τ = 1,043 и
| р, атм | π | γ | 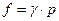
|
| - | 1,0 | 1,0 | |
| 0,359 | 0,9 | ||
| 0,897 | 0,7 | ||
| 1,345 | 0,55 | ||
| 1,794 | 0,47 | ||
| 2,690 | 0,35 | ||
| 3,587 | 0,30 | ||
| 5,381 | 0,27 | ||
| 7,175 | 0,26 | ||
| 8,969 | 0,25 |
Сравнение с предыдущей таблицей показывает, что закон соответственных состояний справедлив при давлениях примерно до 500 атм.
14.4. Летучесть компонента в смеси реальных газов.
Для парциальной летучести компонента fi в смеси реальных газов мы можем записать 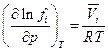
где 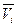 - парциальный мольный объем i-ого газа в смеси. При фиксированной температуре можем получить
- парциальный мольный объем i-ого газа в смеси. При фиксированной температуре можем получить
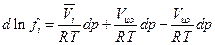
где Vид –мольный объем идеального газа при тех же р и Т, что и парциальный мольный объем компонента i. Далее
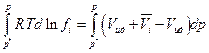 и
и
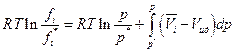
При бесконечно малом давлении р* выполняется закон Дальтона рi = p*xi
где xi – мольная доля i-ого газа, тогда
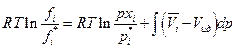
но если р*→ 0, то 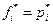 и
и
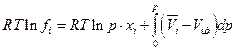
Но для непосредственных расчетов полученное уравнение затруднительно использовать, поскольку парциальным мольным объемом i-ого газового компонента в широком интервале температур и давлений располагать трудно. Поэтому поступим следующим образом : приравняем парциальный мольный объем компонента смеси мольному объему компонента при том же общем давлении : 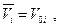 тогда
тогда
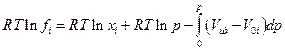
и оказывается, что два последних слагаемых правой части равенства представляют собой 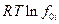 ,где f0i - летучесть чистого компонента i (см. выше). Следовательно :
,где f0i - летучесть чистого компонента i (см. выше). Следовательно :
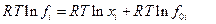 или
или 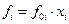
то-есть летучесть компонента смеси равна летучести чистого компонента при давлении, равном общему давлению, умноженной на мольную долю этого компонента в смеси.
Дата добавления: 2015-07-30; просмотров: 1174;
