После логарифмирования и дифференцирования имеем
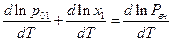
Но 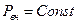 , поэтому
, поэтому
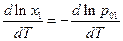
а по уравнению Клапейрона – Клаузиуса
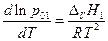
и 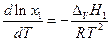
Интегрируем в пределах от х1 = 1 до xi и TV1 до T и, полагая ΔV H1 не зависящей от температуры, имеем
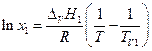 или
или

Обозначим Т – ТV1 = ΔT – это повышение температуры кипения и, положив приближенно 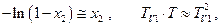 получим
получим
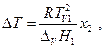 а поскольку
а поскольку 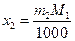
имеем 
где Е – эбулиокопическая константа растворителя.
Аналогично криоскопии эбулиоскопия позволяет определять мольную массу вещества, но нужно иметь в виду, что эбулиоскопические константы меньше криоскопических.
11.4. Термодинамика осмотического давления.
Если растворитель и раствор разделены полупроницаемой (т.е. проницаемой только для молекул растворителя) мембраной, то в силу различия химических потенциалов растворителя в растворе и чистого растворителя через мембрану будет наблюдаться массоперенос (диффузия) растворителя в раствор. Для того, чтобы прекратить массоперенос к раствору нужно приложить некоторое добавочное давление П, которое и называется осмотическим давлением.
Вант – Гофф (1885) впервые предложил для осмотического давления количественную зависимость
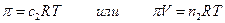
где с2 – концентрация растворенного вещества моль/л ( с2 = п2/V, n2 – число молей растворенного вещества, V- объем раствора), т.е. осмотическое давление в разбавленных растворах численно равно тому давлению, которое производило бы то же число молекул растворенного вещества, если бы оно в виде идеального газа занимало бы при данной температуре объем, равный объему раствора. ( Кстати, первая Нобелевская премия по химии в 1901 году была присуждена Якобу Хенрику Вант-Гоффу за открытие законов химической динамики и осмотического давления в растворах). Но аналогия между уравнением Вант-Гоффа и уравнением состояния идеального газа случайна и не имеет существенного значения. Осмотическое давление является тем добавочным давлением, которое увеличивает химический потенциал растворителя в растворе и этим компенсирует уменьшение химического потенциала растворителя, вызванное растворением второго компонента. Такая компенсация создает возможность равновесия раствора с чистым растворителем в особых условиях наличия полупроницаемой перегородки. В отсутствие последней осмотическое давление отсутствует. Итак, условие равновесия μ1= μ01 и dμ1 = dμ01, где μ01 – химический потенциал чистого растворителяпри постоянной температуре и внешнем давлении р1, в растворе же его значение μ1 изменяется с изменением х1 и давления р2, которое складывается из внешнего и осмотического р2 = р1 + π. Ищем, как меняется осмотическое давление с изменеием концентрации х1 при р1 и Т = Const. В этих условиях
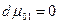 , следовательно и
, следовательно и 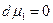 . Имеем
. Имеем
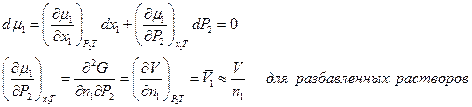
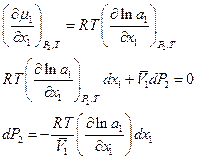
В предположении, что 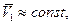 интегрируем от
интегрируем от 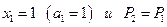
до концентрации 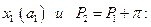
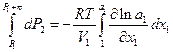 отсюда
отсюда 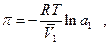 а поскольку
а поскольку
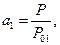 то общее уравнение осмотического давления
то общее уравнение осмотического давления
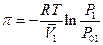
Если раствор подчиняется закону Рауля, т.е. достаточно разбавлен, то Р/Р01=1– х2, и 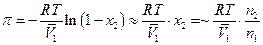 если п2 << n1 , в этом случае
если п2 << n1 , в этом случае
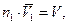 где V объем раствора, и окончательно имеем уравнение Вант-Гоффа
где V объем раствора, и окончательно имеем уравнение Вант-Гоффа 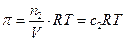
Осмотическое давление 1 молярного раствора равно примерно 25 атм. Осмотические эффекты чрезвычайно важны в биологических системах, поскольку большинство биологических мембран – стенки кишечника, стенки клеток – полупроницаемы.Слишком большой градиент концентрации приводит к разрыву или высушиванию клетки. Очень эффективным осмотическим устройством является человеческая почка, где кровь и моча движутся навстречу друг другу с противоположных сторон ряда полупроницаемых мембран, которые позволяют большинству ионов и низкомолекулярных продуктов обмена веществ перейти из крови в мочу и далее активно перекачивают (используя биохимические процессы) некоторые ионы (нужные Na+ и Cl - ) обратно в кровь.
Измерение осмотического давления растворов высокополимеров очень удобно для измерения их средней мольной массы, поскольку из уравнения Вант-Гоффа следует, что
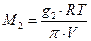
где М2 – мольная масса полимера, g2 – его навеска, V – объем растворителя. Например, раствор 1,372 г полимера в 100 мл воды имеет осмотическое давление 10 мм водяного столба, тогда (Т = 300 К) :
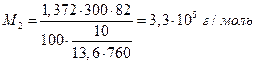
11.5. Коллигативные свойства растворов.
Подведем общий итог для некоторых свойств растворов.
Закон Рауля можно представить в виде
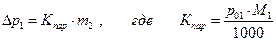
понижение температуры замерзания раствора
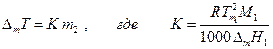
повышение температуры кипения раствора нелетучего вещества
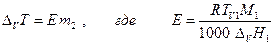
осмотическое давление (уравнение Вант-Гоффа)
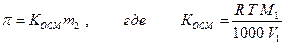
Мы видим, что эти свойства целиком определяются (для разбавленных растворов) свойствами растворителя и линейно зависят только от количества молей растворенного вещества, но не от его природы. Такие свойства, линейно зависящие от моляльности, называются коллигативными.
Коллигативные свойства позволяют получить весьма значительную информацию о частицах, присутствующих в растворах, и о природе сил, действующих в жидком состоянии вещества. Достаточно указать, что кажущееся увеличение моляльности в водных электропроводящих растворах привело Аррениуса к теории электролитической диссоциации.
Но не только вода может быть растворителем, но и серная кислота, Эксперименты показали, что при растворении N2O4 в чистой H2SO4 соответствует присутствию шести молей частиц на моль растворенной N2O4 . Можно предположить, что протекает реакция :
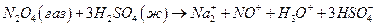
где все ионные частицы сольвaтированы серной кислотой. Аналогичные взаимодействия наблюдаются и для других систем, в том числе и для воды.
Дата добавления: 2015-07-30; просмотров: 967;
