Глава 10. Реальные растворы.
10.1. Термодинамическая классификация растворов.
Реальные растворы не подчиняются законам идеальных растворов Pауля-Генри в форме pi = poi xi . Если давление насыщенного пара над реальным раствором больше, чем над идеальным раствором того же состава, то отклонения от закона Рауля ( отклонения от идеальности) называются положительными, а если меньше – отрицательными. Знак и величина отклонения зависят от природы растворителя и растворенного вещества. Главным образом это связано с энергией взаимодействия однородных и разнородных молекул, а также с размерами молекул обоих компонентов.
Если силы межмолекулярного взаимодействия между однородными и разнородными молекулами значительно различаются, то образование раствора будет сопровождаться изменением объема и выделением или поглощением теплоты. В тех случаях, когда разнородные молекулы притягиваются слабее однородных, то смешение компонентов приведет к ослаблению общего межмолекулярного взаимодействия, в результате процесс растворения протекает с увеличением объема и поглощением теплоты. Выход молекул из такого раствора облегчается, давление пара будет выше, чем рассчитанное по закону Рауля, т.е. в наличии имеются положительные отклонения от законов идеальных растворов. Если же разнородные молекулы притягиваются сильнее, чем однородные, то при смешении таких компонентов объем уменьшится и выделится определенное количество теплоты. Давление же пара будет ниже, чем для идеального раствора того же состава, т.е. будут наблюдаться отрицательные отклонения от законов идеальных растворов.
Некоторые классы растворов получили специальные названия.
Регулярные растворы. Для них
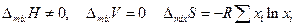
Если теплота смешения сравнительно невелика, то можно предположить, что различие в энергиях взаимодействия однородных и разнородных молекул в растворе невелико и не сказывается на пространственном распределении молекул в растворе, которое остается хаотическим. Иначе говоря, небольшое различие в энергиях взаимодействия однородных и разнородных молекул не вызывает увеличения числа однородных (или разнородных) молекулярных пар по сравнению со средним статистическим. В этом случае энергетическое преимущество этих пар (большее их взаимное притяжение) недостаточно для значительного нарушения хаотического движения молекул. Энтропия смешения таких растворов приближенно приравнивается энтропии смешения идеальных растворов, в которых не образуются предпочтительно какие либо пары молекул. Регулярные растворы очень часто образуются при взаиморастворении органических соединений.
Атермальные растворы. Для них 
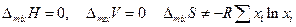 .
.
Отсутствие теплоты смешения характерно для идеального раствора, но и неидеальные растворы могут обладать этим свойством. Такие атермальные растворы можно рассматривать как идеальные по своим энергетическим свойствам растворы, которые не подчиняются закону Рауля вследствие значительного различия в величинах молекул компонентов и вытекающего отсюда значительного различия в молекулярных объемах.Увеличение различия между мольными объемами приводит к отрицительным отклонениям от закона Рауля. Атермальные растворы рассматриваются как более общий случай, чем идеальные растворы. Они являются предельным случаем, к которому близки растворы неполярных компонентовс сильно различающимися молекулярными объемами, например, растворы полимеров в своих мономерах.
Заметим в заключение, что при достаточно больших как положительных, так и отрицательных отклонениях от законов идеальных растворов на зависимости общего давления пара раствора от его состава могут появиться экстремумы, а, следовательно, и азеотропы.
10.2. Активность и коэффициент активности.
Растворы с идеальным поведением не такая уж экзотика. Такими являются, например, растворы изотопов, бензол-этиленхлорид, гексан-октан, бензол-толуол, бензол-хлоритензол и т.п. Например, поведение при 50 0С смесей С6Н6 и C2H4Cl2 выглядит следующим образом (давление в торр)
| 
| 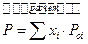
| ||
| 268,0 | 268,0 | - | ||
| 0,1152 | 33,4 | 232,9 | 263,3 | 263,2 |
| 0,2722 | 70,5 | 188,5 | 259,0 | 258,5 |
| 0,494 | 124,6 | 127,4 | 252,0 | 251,4 |
| 0,7296 | 178,1 | 65,8 | 243,9 | 244,0 |
| 0,9100 | 217,2 | 21,5 | 238,7 | 238,7 |
| 1,000 | 236,2 | 236,2 | - |
Дата добавления: 2015-07-30; просмотров: 4754;
