Буферные растворы.
Растворы, рН которых относительно мало изменяется при добавлении
небольших количеств кислоты или основания, называются буферными
Способность раствора поддерживать определенное значение рН называется буферным действием.
Буферное действие раствора измеряется буферной емкостью, т.е. тем количеством кислоты или щелочи в г/экв, которое требуется прибавить к 1 литру раствора, чтобы значение его рН изменилось на единицу.
Основные виды буферных растворов:
1. Слабая кислота и ее соль
(СН3СООН + СН3СООNa); (H2CO3 + NaHCO3)
2. Слабое основание и его соль
(NH4OH + NH4Cl)
3. Две кислые соли
(NaH2PO4 + Na2HPO4)
4. Кислая и средняя соль
(NaHCO3 + Na2CO3)
Буферирование играет важную роль в природе и технике. В организме человека рН меняется очень незначительно вследствие буферных свойств растворов во всех системах. Буферные растворы (NaHCO3 + Na2CO3) и (NaH2PO4 + Na2HPO4) рН 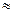 7 поддерживают рН физиологическихжидкостей.
7 поддерживают рН физиологическихжидкостей.
Мало изменяется рН морской воды (рН= 8,0). При проведении многих
технологических процессов рН среды поддерживают постоянным с помощью
буферных систем.
Буферное действие смеси рассмотрим на примере ацетатного буферного раствора.
1. Добавим к буферному раствору щелочь
СН3СООН + ОН- 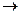 СН3СОО- + Н2О м/д соед.
СН3СОО- + Н2О м/д соед.
Увеличение рН не происходит, т.к. ион ОН- связывается в мало диссоциирующее соединение.
2. Добавим кислоту
СН3СОО- + Н+ 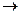 СН3СООН
СН3СООН
Снижение рН не происходит, т.к. ион Н+ связывается в мало диссоциирующее соединение.
Дата добавления: 2015-08-11; просмотров: 1446;
